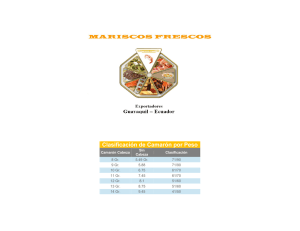
Sin título de diapositiva - Biblioteca
Anuncio

INSTITUTO TECNOLÓGICO DE SONORA DIRECCIÓN DE INVESTIGACIÓN Y ESTUDIOS DE POSGRADO ESTUDIO CIRCADIANO DE LA PRODUCCIÓN DE ENZIMAS DIGESTIVAS DE CAMARÓN BLANCO Litopenaeus vannamei, DURANTE UN CULTIVO SEMI-INTENSIVO TESIS QUE PARA OBTENER EL GRADO DE MAESTRA EN CIENCIAS EN RECURSOS NATURALES PRESENTA CLAUDIA PÉREZ GASTÉLUM CD. OBREGÓN, SONORA SEPTIEMBRE DE 2002 ii ÍNDICE RESUMEN ÍNDICE ....................................................................................................... i ............................................................................................................ ii ÍNDICE DE TABLAS ...................................................................................... ÍNDICE DE FIGURAS Y GRÁFICAS v .............................................................. vi I. INTRODUCCIÓN ........................................................................................ 1 1.1 Antecedentes .......................................................................................... 1 1.2 Planteamiento del problema .................................................................... 3 1.3 Justificación ............................................................................................. 4 1.4 Objetivo .................................................................................................... 5 1.5 Hipótesis .................................................................................................. 5 II. FUNDAMENTACIÓN .................................................................................. 6 2.1 La camaronicultura en el mundo .............................................................. 6 2.2 Especies de camarón factibles de cultivo en México ............................. 7 2.3 Cultivo de camarón en Sonora. ............................................................... 8 2.4 Aspectos tecnológicos del cultivo de camarón ........................................ 10 2.4.1 Generalidades ................................................................................... 10 2.4.2 Los cultivos extensivos ...................................................................... 11 2.4.3 Los cultivos semi-intensivos .............................................................. 11 2.4.4 Los cultivos intensivos ....................................................................... 12 2.4.5 Los cultivos súper intensivos ............................................................. 12 2.5 Biología del camarón ............................................................................... 13 2.5.1 Características generales del camarón blanco (Litopenaeus vannamei) ....................................................................................... 13 2.5.2 Ciclo de vida del camarón .................................................................. 14 2.5.3 Anatomía del camarón ....................................................................... 16 2.5.3.1 Exoesqueleto ............................................................................ 17 2.5.3.2 Apéndices con función alimenticia ........................................... 18 2.5.3.3 Estómago e intestino ................................................................. 18 2.5.3.4 Hepatopáncreas o glándula digestiva del intestino medio ........ 19 iii 2.6 Fisiología digestiva del camarón .............................................................. 20 2.6.1 Fenómenos nutricionales ligados al crecimiento ............................... 20 2.6.2 El aparato digestivo del camarón ....................................................... 21 2.6.2.1 El tubo digestivo ........................................................................ 22 2.6.2.2 El estómago .............................................................................. 22 2.6.2.3 Piezas masticadoras del estómago .......................................... 22 2.6.2.4 La trituración en el estómago .................................................... 23 2.6.2.5 Contracciones del tubo digestivo .............................................. 24 2.6.3 Degradación química de los alimentos .............................................. 24 2.6.4 Enzimas digestivas ............................................................................ 25 2.6.5 Variación de las actividades enzimáticas digestivas ......................... 27 2.6.5.1 Variación a lo largo de la intermuda ......................................... 27 2.6.5.2 Variaciones circadianas ............................................................ 27 2.6.5.3 Variaciones durante el desarrollo larvario ................................. 27 2.7 La alimentación y nutrición del camarón blanco ...................................... 28 2.7.1 Requerimientos nutricionales del camarón blanco ............................ 30 2.7.1.1 Proteína .................................................................................... 30 2.7.1.2 Lípidos ...................................................................................... 31 2.7.1.3 Fibra .......................................................................................... 32 2.7.1.4 Vitaminas .................................................................................. 32 2.7.1.5 Minerales .................................................................................. 34 2.7.2 Factores de calidad importantes del alimenta balanceado para camarón .................................................................................. 35 2.7.2.1 Atractabilidad y palatabilidad ..................................................... 35 2.7.2.2 Apariencia .................................................................................. 35 2.7.2.3 Estabilidad en el agua ................................................................ 36 2.7.2.4 Tamaño del pellet ...................................................................... 2.7.3 Manejo del alimento 37 ......................................................................... 37 2.7.3.1 Estrategias convencionales de manejo del alimento ................ 38 III. MÉTODO ................................................................................................... 43 3.1 Descripción del área ............................................................................... 43 3.2 Sitio experimental ................................................................................... 44 iv 3.3 Diseño del experimento .......................................................................... 44 3.4 Preparación de los extractos enzimáticos ............................................ 44 3.5 Determinación de proteínas .................................................................... 45 3.6 Determinación de la actividad de la proteasa ........................................ 45 3.7 Determinación de la actividad de la lipasa .............................................. 45 3.8 Determinación de la actividad de la amilasa ........................................... 46 IV. RESULTADOS Y DISCUSIÓN ................................................................ V. CONCLUSIONES Y RECOMENDACIONES .......................................... BIBLIOGRAFÍA ................................................................................................. 47 58 60 v DEDICATORIAS A Dios Por todas las cosas buenas con las que ha llenado mi vida... A mi esposo Jorge Luis Porque mis esfuerzos van encaminados a ser la gran mujer que hay tras cada gran hombre como tu. Te Amo... A mis padres Adán y Tere Porque ellos han hecho de mi una mujer feliz y realizada al brindarme su amor y su apoyo siempre. A mis hermanos Yanett Karina, Adán y Andrés A ese trío de locos que tanto quiero y que son la razón mas fuerte de mi superación. A mi Pequeña María Renné Porque es el hilo de amor y ternura que une a toda la familia y nos llena de ilusiones. A Patty Por ser esa amiga que quisiera tener toda la vida. A mis compañeros Jorge Robles, Ramses Cuevas, Jorge Cabrera, Manuel Garibaldi, Dulce Rochín y Jorge Peña. Porque formamos un verdadero equipo con mucho talento y corazón. Logramos hacer de cada trabajo un deleite, de cada clase el momento de armonía esperado al final del día y de cada reunión un abrazo de amigos. A mi maestro consentido Dr. Fernando Lares Villa Porque en esos momentos de desesperación Con sus sabias palabras y su gran habilidad de volver lo negro blanco me indicó el camino y me hizo valorar mis esfuerzos. AGRADECIMIENTOS Al Instituto Tecnológico de Sonora : Por ser ya mi segunda casa y porque me ha permitido siempre realizar mis anhelos profesionales A la Dirección de Investigación y Estudios de Postgrado: Por mi formación y las facilidades brindadas para la elaboración de este proyecto. Al Dr. Héctor Nolasco Soria Y al Biol. Ramón Casillas Hernández: Por la confianza depositada en mi al darme la oportunidad de trabajar en este proyecto y por todo el apoyo y las facilidades brindadas. Al Dr. Fernando Lares Villa: Por ser mi asesor, mi maestro y porque con su gran profesionalismo y sensibilidad hizo posible la culminación de este trabajo. A mi comité revisor: M. en C. Odilón Valdenebro Ruiz y M.en C. Cuauhtémoc Ibarra Gámez Por su valioso tiempo y talento invertidos y por su constante apoyo. Al M. en C. Enrique Montaño: Por su apoyo constante y por ser mas que un maestro...un guía A mis maestros: M. en C. Guadalupe Aguilar , M. en I. Anacleto Félix y M. en C. Luciano Castro: Por sus enseñanzas y todo su apoyo incondicional. ÍNDICE DE FIGURAS Y GRÁFICAS FIGURAS PÁG. 1 Ciclo de vida del camarón ..................................................................... 16 2 Anatomía externa del camarón ................................................................ 17 3 Sistema digestivo del camarón ................................................................ 19 4 Hepatopáncreas o glándula digestiva del intestino medio ....................... 20 Ciclo circadiano de actividad de la proteasa en camarones de 7 gramos ................................................................................................... 48 Ciclo circadiano de actividad de la proteasa en camarones de 20 gramos ................................................................................................. 48 Ciclo circadiano de actividad de la proteasa en camarones de 25 gramos ................................................................................................. 49 Ciclo circadiano de actividad de la proteasa en camarones de 30 gramos ................................................................................................. 50 Ciclo circadiano de actividad de la proteasa en camarones alimentados .............................................................................................. 51 Ciclo circadiano de actividad de la proteasa en camarones en ayuno ................................................................................................... 51 Ciclo circadiano de actividad de la lipasa en camarones de 7 gramos ................................................................................................... 53 Ciclo circadiano de actividad de la lipasa en camarones de 20 gramos ................................................................................................. 53 Ciclo circadiano de actividad de la lipasa en camarones de 25 gramos ................................................................................................ 54 Ciclo circadiano de actividad de la lipasa en camarones de 30 gramos ................................................................................................. 55 Ciclo circadiano de actividad de la lipasa en camarones Alimentados ................................................................................................ 56 Ciclo circadiano de actividad de la lipasa en camarones en ayuno ........... 56 GRÁFICAS 1 2 3 4 5 6 7 8 9 10 11 12 ÍNDICE DE TABLAS PÁG. 1 Granjas camaroneras en producción y en dictamen en el sur de Sonora (Junio de 2000) ........................................................................ 10 2 Especies de camarón agrupados por género ............................................ 14 3 Niveles recomendados de proteína en alimentos comerciales Para camarón....................................................................................................... 31 Niveles recomendados de lípidos en dietas comerciales para camarón ...................................................................................................... 32 5 Tamaño recomendado para pellets de camarón ......................................... 37 6 Tasas de alimentación recomendadas por peso corporal por día ............... 38 7 Horario de alimentación y porcentaje de la ración diaria en cada alimento empleada comúnmente .............................................................................. 39 4 RESUMEN Las variaciones circadianas de las enzimas digestivas en varias especies de camarones son ya del interés científico y han podido ser reconocidos como parte importante de la fisiología de estos organismos. En este estudio se investigó el ritmo circadiano de producción de enzimas digestivas (proteasas, amilasas y lipasas) de camarón blanco Litopenaeus vannamei, durante un cultivo semi-intensivo, trabajándose con organismos de 7, 20, 25 y 30 gramos en promedio, alimentados y sin estímulo alimenticio externo. Se encontró un ritmo circadiano al menos bifásico tanto para organismos alimentados como para los mantenidos en ayuno. Los patrones de actividad de proteasas y lipasas presentaron variaciones aún mantenidos en condiciones de ayuno, sin encontrarse diferencia entre el día y la noche. Los picos de actividad variaron al incrementarse la talla del camarón. Se manifestó un deterioro en la amilasa por las condiciones de este estudio y el tiempo de congelación, por lo que no fue posible estudiarla. El estímulo alimenticio influyó en la actividad lipásica mostrando mayor tendencia a aumentar en los animales alimentados respecto a los mantenidos en ayuno, y no así en el caso de proteasas, donde la actividad permanece fluctuando sobre los mismos niveles en ambos casos. I. INTRODUCCIÓN 1.1 Antecedentes La acuacultura en general y la camaronicultura en particular, han mostrado ampliamente su capacidad de crecimiento tanto a nivel nacional como mundial, al constituir ya, un elevado porcentaje de la producción (Ocaña,1991). Aunque la camaronicultura es una de las ramas de la acuacultura de mayor eficiencia y avanzado desarrollo tecnológico, sus antecedentes mundiales se remontan a varios siglos, con el registro de cultivos rústicos e incidentales, así como de experiencias relativamente refinadas, como en el caso de ciertos pueblos asiáticos y mesoamericanos (Gómez et al., 1997). De acuerdo con numerosos autores, son pocas las especies, que por sus características y nivel de conocimiento de las mismas, han alcanzado el nivel necesario para una producción sostenida. Entre otras se puede citar a Marsupenaeus japonicus, Penaeus monodon, Litopenaeus vannamei, Litopenaeus stylirostris, Fenneropenaeus penicillatus, 2 Fenneropenaeus merguiensis, Litopenaeus occidentales, Litopenaeus setiferus y Litopenaeus schimitii (Alfonso y Ramos., 1993). El cultivo de camarón se ha convertido gradualmente en una importante actividad generadora de empleos y divisas a nivel mundial (Gómez et al.,1997). La validación mundial de tecnologías de cultivo permite hoy contar con camarón de talla, calidad y cantidad predeterminadas en el momento oportuno para un mercado en expansión (Juárez, 1999). En la actualidad, el camarón es considerado dentro de los recursos pesqueros más relevantes en México; los principales estados productores son Sinaloa, Sonora y Nayarit generando más de 30,000 toneladas de camarón en 1999 [Instituto de Acuacultura del Estado de Sonora (IAES) y Secretaria de Desarrollo Económico y Productividad (SEDEPRO),2001]. Sonora ocupa el segundo lugar a nivel nacional como productor de camarón, debido en gran medida a que cuenta con las condiciones ambientales adecuadas, dominio tecnológico, asistencia técnica, infraestructura, fuentes de financiamiento y las dependencias de apoyo para el desarrollo de esta actividad. El Estado de Sonora cuenta con 100,000 hectáreas aptas para la construcción de estanquería hectáreas para cultivos marinos. Sonora aprovecha actualmente el 7.5%, con 7,500 abiertas al cultivo, donde 65 grupos productores desarrollan la producción camaronícola, con una producción de 12,304 toneladas en el año 2000 (IAES- SEDEPRO, 2001). Dada la importancia que ha tomado el cultivo de camarón es preciso realizar estudios tendientes a conocer a fondo aquellos factores de los cuales depende la producción. Entre éstos, uno de gran trascendencia es la alimentación (Abraham et al., 1997). El alimento balanceado de camarón actualmente es considerado el insumo de mayor costo en el cultivo de camarón, dada esta premisa los productores se han dado a la tarea de encontrar la manera mas eficiente y económica de alimentar a los organismos mediante el 3 empleo de prácticas adecuadas que permitan obtener una tasa de conversión alimenticia óptima, sin sacrificio en el crecimiento del crustáceo. Existen diferentes técnicas para determinar el suministro de alimento a los camarones como son las tablas de alimentación, revisión del tracto digestivo, utilización de charolas comederos (sistema peruano) y la utilización de charolas como testigo de consumo. Lo más recomendable es utilizar las charolas como testigos y apoyarse en algunas técnicas antes referidas (Juárez, 1999). Desde el punto de vista comercial, el alto costo de las raciones balanceadas hacen necesario llevar a cabo investigaciones relacionadas con el manejo de la alimentación, para obtener una mayor rentabilidad de los proyectos de cultivo de camarón en sistemas intensivos. Además, es necesario minimizar el impacto ambiental generado por la sobrealimentación de los estanques, lo que ocasiona la eutroficación del agua y sedimentos de material orgánico en los fondos de la estanqueria (Cortés, 1993). Las estrategias de alimentación se han basado generalmente en aspectos prácticos para establecer los horarios de alimentación y este trabajo pretende estudiar el ritmo circadiano de producción de enzimas digestivas del camarón blanco Litopenaeus vannamei y proponer que estos ritmos sean considerados para establecer los horarios de alimentación de los cultivos y permitir así un mayor aprovechamiento del alimento. 1.2. Planteamiento del problema El éxito de la camaronicultura depende grandemente de una adecuada nutrición y de un buen manejo del alimento. Por lo que es de radical importancia la investigación relacionada con los requerimientos nutricionales del camarón y los métodos de alimentación empleados. La alimentación de los estanques camaroneros se basa mayormente en aspectos prácticos para calcular las raciones diarias a partir de un porcentaje de la biomasa y del peso promedio de los camarones presente en el estanque, sin considerar alimentación ni el estado fisiológico por el que atraviesa el camarón. los hábitos de 4 Además, considerando que el costo del alimento balanceado puede alcanzar hasta el 50% del costo de producción, dependiendo del sistema de cultivo utilizado, especie, manejo, calidad de agua y tipo de alimento, es de gran importancia encontrar estrategias de alimentación que permitan disminuir estos gastos . Para alcanzar este objetivo es necesario estudiar los procesos fisiológicos del organismo que afectan la capacidad de consumo y digestión del alimento, en el cual la actividad enzimática cumple una acción de vital importancia. Con lo anterior y considerando que en Sonora predominan los sistemas de cultivo semi-intensivo de camarón blanco, nace la pregunta ¿Cómo varía en el ciclo circadiano la producción de enzimas digestivas del camarón blanco Litopenaeus vannamei durante un cultivo semi-intensivo? 1.3 Justificación El cultivo de camarón blanco L. vannamei se ha convertido en una importante actividad económica para el sur de Sonora, ocupando el segundo lugar en productividad a nivel nacional. Para la camaronicultura, la alimentación es de gran importancia, por lo que es muy importante generar resultados científico-prácticos que sustenten un aprovechamiento eficiente del alimento. Esta investigación es de interés tanto científico como económico: - La relevancia científica se basa en la generación de información acerca de la fisiología digestiva y la variación de enzimas digestivas en el ciclo circadiano del camarón blanco L. vannamei. - Para el sector productivo es de gran importancia el disminuir los costos de alimentación al ajustar los horarios de alimentación y las dosis suministradas de acuerdo a los picos de máxima actividad de las enzimas digestivas. 5 1.4 Objetivo Conocer el ciclo circadiano de producción de enzimas digestivas (proteasas, amilasas y lipasas) del camarón blanco Litopenaeus vannamei durante un cultivo semi-intensivo y establecer la influencia de la alimentación y la talla del organismo con el ciclo circadiano de producción de enzimas digestivas. 1.5 Hipótesis En base a estudios realizados en otras especies de crustáceos se espera que la producción de enzimas digestivas de camarón blanco Litopenaeus vannamei se verá influenciada por el ciclo circadiano, la alimentación y la talla del organismo. II. FUNDAMENTACIÓN 2.1 La camaronicultura en el mundo El cultivo de camarón se inicio en el sureste de Asia, hace mas de cinco siglos, utilizando métodos rudimentarios, mediante los cuales las postlarvas eran atrapadas en campos de arroz, lechos salados y esteros para ser cosechadas tres o cuatro meses después. En el año de 1959, Motosaki Fuginaga establece un criadero y una granja piloto, en la cual se logra por primera vez la reproducción y crianza parcial del camarón Kuruma (Marsupenaeus japonicus) en cautiverio, hecho de gran trascendencia ya que permitió dominar casi por completo la biotecnología de su cultivo y su consecuente propagación en los años 60’s. (Shigueno, 1975). Los estudios del cultivo de camarones en estanques comenzaron en Estados Unidos a principios de la década de los 50’s. Gracias al trabajo de muchos investigadores y cultivadores de la industria privada alrededor del mundo, la tecnología del cultivo de camarón se encuentra actualmente desarrollada hasta el punto en que se ha completado el control 7 sobre todo el ciclo de vida de algunas especies de camarones, para alcanzar producciones rentables y predecibles. Sin embargo, debido a lo elevado de los costos de producción y la falta de infraestructura científica y técnica en algunos países de América Latina, el desarrollo de la camaronicultura se ha basado principalmente en la engorda de juveniles capturados en el medio natural. Una alternativa a la obtención de postlarvas de camarón del medio costero, ha sido la producción de postlarvas en ambientes controlados de laboratorios las cuales pueden ser proporcionadas al cultivador de acuerdo a la programación y a los volúmenes necesarios para su cultivo. En estas condiciones, uno de los problemas fundamentales se ha basado en definir y controlar las características del medio como la temperatura, concentración del oxígeno disuelto, salinidad, pH, composición hidroquímica, tipo de luz y los factores densodependientes tales como la cantidad del alimento óptimo para la producción postlarvas. Actualmente un grupo importante de especies son cultivadas con gran éxito en diversos países tropicales. (Avault,1992). Hoy, la camaronicultura se encuentra establecida aproximadamente en 40 países, con el cultivo de 8 especies; de acuerdo a las estadísticas de la FAO, Japón es el mercado más importante, seguido por la Unión Europea y después Estados Unidos (Juárez,1999). El cultivo de camarón ha proyectado un enfoque adecuado a países en desarrollo, como lo muestra el éxito alcanzado en Latinoamérica, especialmente en Ecuador, donde el 80% del volumen de exportación de camarón proviene de las granjas de cultivo, al grado de ser incluso el recurso renovable más importante de ese país. 2.2 Especies de camarón factibles de cultivo en México El cultivo de camarón en México, esta fundamentado en 3 especies: el camarón blanco (Litopenaeus vanamei), camarón azul (L. stylirostris) y el camarón café (Farfantepenaeus californiensis). En la actualidad, el camarón blanco representa el 90% del cultivado, el camarón azul el 8% aproximadamente y el 2% restante lo constituye el camarón café. (Lobato,1990). 8 2.3 Cultivo de camarón en Sonora En el Estado de Sonora la actividad camaronícola inició en el año de 1974 con la puesta en funcionamiento del “Centro Acuícola de Puerto Peñasco”. No obstante el desarrollo de la camaronicultura se presentó como actividad importante a principios de los 90’s. La crisis del sector pesquero a finales de la década de los 80’s y principios de los 90’s y en especial del sector camaronero dejó ver de manera muy clara la necesidad de impulsar la reconversión productiva en la captura del camarón pasando de su obtención en alta mar a su cultivo en granjas acuícolas por lo que el fomento de la camaronicultura es una de las prioridades estratégicas del gobierno de Sonora. Indudablemente la región costera del sur de Sonora es la que tiene el mayor desarrollo de camaronicultura en el Estado; esta tendencia se ha visto favorecida por la sequía que ha provocado que los desempleados de las actividades agrícolas fijen su interés hacia la franja costera incursionando en la pesca o asociándose en agrupaciones civiles que promueven proyectos acuícolas y en particular en la camaronicultura. En el año 1989, el gobierno del Estado a través del Programa Agrario Integral de Sonora (PAIS), inició los estudios tendientes a determinar el establecimiento de 5,500 hectáreas de marisma con vocación acuícola con el objeto de resolver las demandas de los solicitantes de tierras. La infraestructura proyectada se dividió en cuatro módulos denominados: Los Mélagos, La Atanasia, El Tóbari y El Siari, todos ellos ubicados en complejos estuarinos del sur de Sonora. El enorme sacrificio que significó el acceso a la tierra, la obtención de créditos, y apoyos para los proyectos y la capacitación de los campesinos, despertó en ellos el interés por trabajar la tierra de manera colectiva, con sus propias manos, a participar en la toma de decisiones, a organizarse y a manejar de manera empresarial sus proyectos. 9 Los factores de éxito se atribuyen a la entrega absoluta de ejidatarios a su proyecto, pero también ha sido factor fundamental la participación del gobierno del estado y del FONAES (Fondo Nacional de Empresas en Solidaridad), principalmente. Por un lado, el gobierno del estado desde sus inicios, ha fortalecido e impulsado la acuacultura en Sonora, aportando recursos para la construcción de obras de infraestructura y de uso común, asesoría técnica y administrativa, pero sobre todo, el estímulo permanente a los ejidatarios y a sus organizaciones sociales. Por otro lado, el FONAES, en apego al plan nacional de desarrollo 1995–2000, combate la pobreza y la marginación social, aportando capital de riesgo para la construcción de granjas acuícolas, además de programas permanentes de capacitación para los ejidatarios, con la finalidad de elevar el nivel de vida de la población del sector social. En el Primer Informe de gobierno del Lic. Armando López Nogales, se reportó 3,935 hectáreas de cultivo para 1997 y en 1998 hubo un incremento a 4,500 has, y se obtuvo un aumento en la producción de 4,244 a 8,375 toneladas generando ingresos en beneficio de 1500 familias del Estado de Sonora. Los datos más recientes registran 13 laboratorios de postlarvas de camarón y 19 granjas camaroneras funcionando (reportadas oficialmente) para el Estado, en un total de 2 mil 333 hectáreas (IAES-SEDEPRO, 2001) Es importante señalar que el total de hectáreas de los parques acuícolas que se mencionan en diferentes artículos publicados y reportes, no coinciden, esto puede ser ocasionado por la confusión que se tiene sobre la integración y estructura funcional de los parques anteriormente mencionados (Tabla 1). 10 Tabla 1. Granjas camaroneras en producción y en dictamen en el sur de Sonora (junio 2000) Sistema Operando Superficie Producción Dictamen Superficie lagunar No. ha Ton No. ha Guaymas 1 69 88.5 0 0 Guásimas 0 0 0 1 100 Bahía de Lobos 1 102 85 5 947 Mélagos-Atanasia 23 2445 9254.3 5 780 Tóbari-Siari 14 911 2311 4 530 Aquiropo-Moroncarit 12 989 599.2 9 1850 Yavaros 0 0 0 3 175 Agiabampo 2 81 9 3 318 Total 53 4597 12347 30 4700 Fuente: Directorio Estatal de Acuacultores 2001. IAES-SEDEPRO. 2.4 Aspectos tecnológicos del cultivo de camarón 2.4.1 Generalidades En los litorales mexicanos existen ocho especies de importancia comercial, de las cuales cuatro se distribuyen en el Pacífico, tres en el Golfo de México y una en el Mar Caribe. La tecnología de cultivo sólo ha sido validada para la mitad de ellas. La clave del éxito de un proyecto camaronícola está en la aplicación apropiada de la tecnología de cultivo para maximizar la producción al menor costo posible. La ganancia obtenida por hectárea de estanque de cultivo es muy sensible a los volúmenes producidos y al tamaño de los animales obtenidos. El precio del mercado varía considerablemente con el tamaño de los organismos, de modo que los animales más grandes alcanzan un precio considerablemente mayor que los pequeños. 11 El volumen de producción depende de las densidades de cultivo en los estanques y de su manejo. Desde el punto de vista de los niveles de densidad y producción, los sistemas de cultivo pueden ser clasificados en extensivos, semi-intensivos, intensivos y súper intensivos. 2.4.2 Los cultivos extensivos Las granjas de cultivo extensivo o de baja densidad son utilizadas generalmente en los trópicos, en embalses de agua de poca profundidad a lo largo de las bahías y estuarios, a menudo cultivando camarón de manera conjunta con peces herbívoros. Estos embalses varían su tamaño de una a cien hectáreas. Cuando se sabe que el agua contienen una alta densidad de camarón, los granjeros abren las compuertas encerrando al camarón silvestre y engordándolo hasta talla comercial. Los pescadores también capturan juveniles silvestres y lo venden para su siembra a los granjeros. Las densidades de siembra pueden ser hasta de 25,000 juveniles por hectárea (2.5 juveniles/m2). Las mareas proveen el recambio de agua en un rango de 5 a 10% diario; la alimentación es natural y/o promovida por la aplicación de fertilizantes orgánicos o comerciales Valdenebro (1996). Los costos de producción y operación son bajos. Mediante redes y trampas de bambú se recogen las cosechas de 50 a 500 kilos de camarón con cabeza por hectárea por año. 2.4.3 Los cultivos semi-intesivos Este sistema de cultivo es utilizado por arriba del nivel máximo de mareas. Incluye generalmente la utilización de estanque de maternidad, engorda en estanques construidos a cielo abierto de 5 a 25 hectáreas, alimentación artificial y bombeo del agua. 12 El recambio de agua varía del 10 al 20% diario. La densidad de siembra puede ser de 25,000 a 200,000 crías por hectárea, al existir mayor competencia por la alimentación se complementa con alimento comercial Valdenebro (1996). Las crías silvestres o producidas en laboratorios son sembradas en los estanque de maternidad a alta densidad, hasta alcanzar una talla adecuada para ser sembradas en los estanques de engorda a baja densidad. Los granjeros cosechan vaciando por gravedad el agua de los estanques a través de una red. La producción varía de 500 a 5,000 Kg con (cabeza) al año; se requiere mantenimiento después de las cosechas. 2.4.4 Los cultivos intensivos La producción intensiva de camarón comprende el uso de pequeños cuerpos de agua de 0.01 a 5hectáreas, altas densidades de siembra (30 a 100 camarones/m2), manejo técnico constante, fuerte suministro de alimento balanceado, remoción de desechos y aireación; la aplicación de aire y oxígeno al agua permite mayores densidades de siembra y cantidades de alimento. El recambio de agua es de 30% diario o más, frecuentemente son utilizados estanque pequeños, aunque también se emplean canales rápidos o “raseways” y tanques, los cuales pueden estar a cielo abierto o cubiertos. Técnicas sofisticadas de cosecha y de limpieza de estanque permiten una producción casi constante. Se pueden obtener producciones de hasta 2000 a 18000 kg/ha. Valdenebro (1996). 2.4.5 Los cultivos súper intensivos Otro tipo de cultivos intensivos han sido clasificados como súper intensivos, la tecnología incluye la producción de semilla y su engorda en canales de flujo en los que se han obtenido producciones hasta de 50 ton/ha/año (Mazón-Suástegui, et al., 1996). 13 2.5 Biología del camarón Los camarones son artrópodos pertenecientes a la clase Crustácea, son organismos mandibulados con apéndices birrámeos articulados, con dos pares de antenas, branquias, caparazón; presenta larva nauplio y son de hábitos acuáticos; poseen un gran potencial reproductivo, ya que las hembras pueden desovar hasta un millón de huevecillos. (Barnes, 1993). Los miembros del subgénero Litopenaeus, son de télico abierto sin receptáculo espermático. a ese grupo pertenecen algunas especies americanas de gran importancia comercial, tales como: L. vannamei, L. stylirostris y L. setiferus. (tabla 2). 2.5.1 Características generales del camarón blanco (Litopenaeus vannamei) Litopenaeus vannamei es la especie de camarón más cultivada en América. Este camarón se encuentra distribuido naturalmente en las costas del Océano Pacífico desde México al Perú. Litopenaeus vannamei, comúnmente llamado “camarón blanco”, es un decápodo del subgénero Litopenaeus. Este tiene rostro dentado, tiene 1 ó 2 dientes bajo el rostro y de 8 a 9 dientes sobre el rostro. “El camarón blanco” es un miembro del subgénero Litopenaeus a causa de que las hembras de esta especie son de télico abierto, sin receptáculo seminal. 14 Tabla No. 2. Especies de camarón agrupados por género. SUBGÉNERO Litopenaeus ESPECIE L. vannamei SUBGÉNERO Marsupenaeus ESPECIE M. japonicus L.stylirostris L. setiferus Farfantepenaeus F. aztecuz L. schimitti F. duorarum L. occidentales F. brasiliensis F. paulensis F. subtilis Penaeus P. monodon F. californiensis P. esculentus P. semisulcatus Melicertus Fenneropenaeus M. kerathurus F. merguiensis M. marginatus F. penicillatus M. plebejus F. indicus F. chinesis Fuente: Holtschmit (1999). 2.5.2 Ciclo de vida del camarón El camarón es un crustáceo cuyo ciclo biológico se desarrolla típicamente, tanto en altamar como en las lagunas litorales. La reproducción ocurre en mar abierto principalmente en primavera y verano. El macho sigue a una sola hembra, con la que se une centralmente. Los machos poseen un par de testículos y almacenan los espermatozoides en una bolsa llamada espermatóforo. En el primer par de patas posteriores o pleópodos tienen un órgano copulador, el petasma, que es una estructura dura y alargada y con la cual transfieren el espermatóforo a la hembra. El aparato reproductor de las hembras esta constituido por un par de ovarios comunicados con los poros genitales localizados en la región ventral. posee además una estructura 15 externa quitinizada llamada télico, con la que reciben el espermatóforo del macho durante la cópula. Después de cierto tiempo, las hembras expulsan los gametos femeninos y son fecundadas por los gametos masculinas alojadas en el espermatóforo. Cada hembra libera entre 500 mil y un millón de óvulos los cuales tienen un diámetro de 0.22 a 0.32 mm. (Orbe y Arias, 1987). Al principio los huevos flotan libremente en el agua, pero después descienden al fondo; la división del huevo ocurre inmediatamente y después de pocas horas comienzan a esbozarse los apéndices. La segmentación total dura entre 12 y 15 horas. Los estadios básicos del desarrollo del camarón son nauplio, protozoea y misis. El estadio de nauplio comprende de 5 a 6 subestadios, el de protozoea y misis tres. Después del estadio de misis, de aproximadamente 4.3 mm de longitud, el camarón se transforma en una postlarva de 5 mm que emigra a las zonas costeras, en el siguiente estadio, el camarón cambia sus hábitos pelágicos a bentónicos y se conoce como juvenil (Holtschmit, 1999). El juvenil se desarrolla en las lagunas costeras y zonas estuarinas someras donde abundan la vegetación y el detritus con los cuales se alimenta. Cuando los juveniles se convierten en pre-adultos de una talla aproximada de 10 cm, regresan al mar donde alcanzan una talla adulta (aproximadamente 17 cm) y se reproducen (Orbe y Arias, 1987). Se puede observar que durante su ciclo de vida (Figura 1), estos animales explotan los recursos de tres ecosistemas diferentes: el ecosistema planctónico durante la etapa larvaria, el ecosistema lagunar en las fases de postlarvas y de juvenil y el ecosistema oceánico demersal en la etapa adulta. Esta capacidad representa una gran ventaja para su supervivencia. El camarón es de rápido crecimiento y vida corta, el crecimiento es en etapas, pues es un organismo que representa mudas de su caparazón, el cual es secretado por la epidermis y está compuesto por quitina, proteína y carbonato de calcio. El animal desprende poco a poco el tegumento viejo y finalmente adquiere un mayor tamaño. Este es un período muy peligroso, pues puede ser atacado fácilmente por peces o por otros camarones. Algunas 16 horas después de la muda la cutícula se endurece y le vuelve la protección contra los depredadores. En su etapa pre-adulta y adulta, los camarones viven asociados al fondo marino y es cuando son accesibles a la pesquería (figura 1). Aproximadamente al año de edad alcanzan la madurez sexual y se reproducen. Pueden llegar a vivir hasta dos años, aunque gran parte de los individuos son capturados por el hombre al año de edad (Siri y Moctezuma, 1989) Fuente: FAO and Multimedia Asia (1999). Figura.1. Ciclo de vida del camarón. 2.5.3 Anatomía del camarón La mayoría de los órganos del camarón, se encuentran en la región del cefalotórax (figura 2). El cerebro es trilobulado, presenta un ganglio supraesofágico. El sistema nervioso es ventral en el tórax y en el abdomen, con los ganglios metamerizados. El corazón es ventral y se conecta directamente con el hemoceloma a través de arterias abdominales ventral y dorsal. El sistema digestivo se compone de una boca, estómago y hepatopáncreas situados en el cefalotórax; un intestino, una glándula intestinal en el abdomen y el ano situado centralmente donde comienza el telson (Martínez, 1999). 17 2.5.3.1 Exoesqueleto Los crustáceos no tienen esqueleto interno pero están cubiertos con el exoesqueleto, el cual proporciona al animal protección contra sus depredadores. El cuerpo puede ser dividido en tres regiones: cabeza, el tórax y el abdomen. La cabeza se compone de cinco segmentos los primeros dos bajo las antenas y los tres restantes bajo los apéndices, cuyo uso es para alimentarse. Los siguientes ocho segmentos pertenecen al tórax, donde los primeros cinco segmentos constan de patas para la locomoción del animal, de aquí el nombre del orden Decapada, o diez pies. La segunda sección del cuerpo esta compuesta por seis segmentos y cada segmento tiene un par de apéndices que se usan para nadar. Para crecer el camarón primero tiene que desechar su exoesqueleto anterior y formar uno nuevo exoesqueleto. En el proceso conocido como “muda” o “ecdisis”, el exoesqueleto se rompe y es liberado por el animal, posteriormente el cuerpo absorbe agua, se hincha y así aumenta su tamaño. Una vez que pasa esto, comienza a formar una nueva cutícula suave que será más grande que la anterior y que al endurecerse será su nuevo exoesqueleto. (Flores, 2000). CEFALOTORAX ABDOMEN COLA Fuente: FAO and Multimedia Asia (1999). Figura 2. Anatomía externa del camarón. 18 2.5.3.2 Apéndices con función alimenticia Para los decápodos, los apéndices ubicados en los metáforas cefálicos, denominados mandíbulas, maxilas y maxílulas, rodean la boca y maceran los alimentos antes de que estos sean introducidos en el esófago, el cual es corto; los tres primeros pares de apéndices torácicos están transformados en patas-maxilas o maxilípedos y también colaboran en la maceración y manipulación del alimento; el resto de los apéndices torácicos tiene función locomotora. En el caso de las antenas y las anténulas, contribuyen en la ubicación y reconocimiento del alimento debido a la capacidad quimioreceptora que poseen. (Martínez, 1999). 2.5.3.3 Estómago e intestino Del esófago se pasa al estómago el cual esta dividido en dos partes: la anterior denominada cardiaca o estomacal, quien reserva los alimentos ingeridos y la parte posterior o pilórica. La parte anterior de ambos estómagos poseen un espeso revestimiento quitinoso con elementos calcáreos, cerdas, espinas, filtros y repliegues que van a contribuir en la molienda del alimento. De acuerdo con esto el estómago está compuesto en su parte interna de una serie de elementos duros y ocíolos que asemejan un aparato masticador y de un conjunto de repliegues y válvulas; además, existe cerca del píloro un conjunto de cerdas, espinas y tubérculos que semejan un filtro. Sobre la parte anterior dorsal del estómago se encuentra una glándula cuyas células tienen aspecto de células sanguíneas, considerándose en términos generales un órgano hematopoyético (Martínez, 1999). Cuando el alimento entra en el tubo digestivo puede seguir diferentes rutas dependiendo del tamaño de la partícula, cuando son grandes, se quedan en la bolsa cardiaca y son enviadas por el movimiento muscular del estómago a la parte dorsal de la bolsa donde son sometidas a una molienda, las partículas suficientemente pequeñas pueden pasar a cada lado de la válvula por unas depresiones laterales o canales cardíacos inferiores las cuales son filtradas y pasan a la glándula del intestino medio o hepatopáncreas. 19 En el estómago, los alimentos ingeridos se convierten en un fluido y se produce la mayor parte de la digestión enzimática. Los movimientos rítmicos del estómago son generados, gracias a una musculatura estriada y la presencia de un ganglio que inerva la parte anterior del tubo digestivo y controla la movilidad rítmica de los dentículos y de la región pilórica. El intestino, de los decápodos se divide en tres partes: intestino anterior o estomodeo, intestino medio o mesenterón e intestino posterior o proctodeo (figura 3), el anterior y el posterior están cubiertos de quitina, cuyo recubrimiento es generado en cada muda, estos dos se originan en el ectodermo; el intestino medio se origina en el endodermo, no está recubierto de quitina y se conforma de parte intestinal y hepatopáncreas. (Martínez, 1999). 3 2 4 1 2 3 4 5 6 BOCA ESTÓMAGO CIEGO ANTERIOR INTESTINO MEDIO CIEGO POSTERIOR ANO 5 1 6 Fuente: FAO and Multimedia Asia (1999). Figura. 3. Sistema digestivo del camarón. 2.5.3.4 Hepatopáncreas o glándula digestiva del intestino medio La función principal de éste es la producción de enzimas digestivas que son secretadas al intestino medio para la degradación enzimática del alimento; sin embargo, contribuye también como órgano reservorio y como órganos de absorción de los productos digestivos. 20 Dicha glándula está conformada por un conjunto de túmulos ciegos, los cuales están constituidos por células de absorción y de acumulación, secretoras y fibrilares. (Martínez, 1999). HEPATOPÁNCREAS Fuente: FAO and Multimedia Asia (1999). Figura 4. Hepatopáncreas o glándula digestiva del intestino medio. 2.6 Filología digestiva del camarón 2.6.1 Fenómenos nutricionales ligados al crecimiento En los crustáceos el crecimiento se produce por mudas o ecdisis sucesivas; se llama exuviación al momento en el cual el animal se desembaraza de su antiguo integumento o exuvia. Inmediatamente después de despojarse de su viejo exoesqueleto el animal aumenta de volumen por absorción de agua. Muy blando aún el crustáceo no podrá alimentarse durante varias horas, incluso varios días, a partir de la muda. Solo las reservas acumuladas durante el periodo anterior de la muda le permitirán sobrevivir a esta crisis fisiológica natural (Martínez, 1999). 21 En los crustáceos el crecimientos es discontinuo y se caracteriza por el almacenamiento de reservas nutritivas (consumo de reservas), en el curso de cada período intermuda. La frecuencia de muda disminuye con la edad. En el huevo las reservas nutritivas están constituidas por el lipovitelo desarrollado durante la ovogénesis. Cuando el vitelo es pequeño las larvas eclosionan rápidamente tras la puesta; una vez agotado el vitelo las larvas se alimentan en sus primeros estadíos de fitoplancton. Las larvas eligen células de diversas especies de algas en función del tamaño de su boca o de la dureza y forma de estas células. Posteriormente las larvas adquieren el comportamiento de animales carnívoros conforme crecen. Las reservas nutricionales de los adultos se encuentran localizadas fundamentalmente en las células de las glándulas digestivas, que en los decapados se sitúa a nivel del intestino medio y suele llamársele hepatopáncreas. Esta denominación no parece muy adecuada ya que este órgano no es ni un hígado ni un páncreas verdadero, razón por la que algunos autores lo denominan glándula del intestino medio. Las sustancias de reserva son principalmente glucógeno, lípidos, vitaminas, pigmentos y sales minerales (calcio sobre todo); también hay reservas de glucógeno en los músculos (Álvarez,1998). 2.6.2 El aparato digestivo del camarón Álvarez (1998), ha realizado grandes investigaciones acerca del aparato digestivo del camarón hace una descripción de sus partes y funciones. Apéndices empleados en la toma de alimentos. En los decápodos los apéndices más delanteros participan en la función de alimentación. Los apéndices pertenecientes a los metámeros cefálicos: las mandíbulas, las maxilas y las maxílulas rodean la boca y dilaceran los alimentos antes de introducirlos al esófago. Los tres pares anteriores de apéndices toráxicos están transformados en patas maxilas (maxilipedos) y también contribuyen a la manipulación y dilaceración de los alimentos. Los restantes apéndices torácicos han conservado su función locomotora. Ya en el estómago los alimentos son reducidos a papilla 22 muy finamente triturada. Las antenas y antenulas juegan un papel muy importante en la quicio-recepción y por lo tanto en la búsqueda y reconocimiento del alimento gracias a las moléculas disueltas que este libera en el medio. 2.6.2.1 El tubo digestivo En los decápodos este es recto, con su parte anterior ensanchada sin diferenciarse en un verdadero estómago. Ellos no poseen una glándula especializada de la digestión. Las células absorbentes y las de reserva constituyen las paredes de este tubo digestivo. El tubo digestivo de los decápodos se divide en tres partes: intestino anterior (estomodeo), intestino medio (mesenteron), intestino posterior (proctodeo). El estomodeo y el proctodeo estan revestidos de quitina y este revestimiento se expulsa en cada exuviación (Álvarez,1998). 2.6.2.2 El estómago En el intestino anterior, se distinguen dos partes: la parte cardiaca o parte estomacal anterior, donde se acumulan los alimentos ingeridos; y la parte pilórica o parte posterior que posee piezas calcáreas, repliegues, filtros, etc., por donde pasan los alimentos en proceso. La mucosa del estómago es similar a la del esófago, presenta muchos pliegues de tallas y formas diversas. En la parte superior del estómago está la glándula dorsal en forma de pezuña de caballo conformada por células de tipo sanguíneo y que se considera como un órgano hematopoyético (Álvarez,1998). 2.6.2.3 Piezas masticadoras del estómago El estómago en su cara interior está provisto de osículos duros, que constituyen un aparato triturante o masticador y de un conjunto de repliegues y válvulas. 23 Cada una de las piezas es manipulada por músculos propios, exteriores a la pared del estómago, controlado por un conjunto de nervios característicos. Estas piezas y repliegues tienen disposiciones y formas muy diversas, según el grupo de crustáceos de que se trate. Todos los osículos, salvo los que están situados en el eje de simetría del estómago, son asimétricos, pares y bilaterales. Un máximo de 33 osículos han sido descritos en estudios de anatomía comparada. Están divididos en 7 categorías que muestran grandes variaciones, soldaduras y expansiones. En ciertas especies los osículos se asocian en placas calcificadas. Estas piezas masticadoras tienen papeles cualitativa y cuantitativamente diferentes, según sus desplazamientos respectivos. Las primeras piezas de la región cardiaca constituye un primer subsistema llamado molino gástrico. Las piezas anteriores más fuertes y calcificadas son osículos particulares que toman el nombre de dientes. El segundo subsistema, de 18 piezas máximo, más pequeñas y menos calcificadas, participa en el funcionamiento del filtrado en la región pilórica. La eficacia de este tipo de estómago está ligada a su complejidad. Por otra parte, la complejidad del aparato masticador de la boca y del estómago varían de manera inversa (Álvarez,1998). 2.6.2.4 La trituración en el estómago Los alimentos se desplazan en el tubo digestivo siguiendo trayectorias complejas, según el tipo de la partícula. La región cardiaca se separa de la Pilarica por la válvula cardio-pilórica formándose en el estómago dos bolsas contiguas. Las partículas de mayor tamaño se quedan en la región cardiaca y son dirigidas por los movimientos de los músculos del estómago a la parte dorsal de dicha región, para ser tratadas por la pieza del molino gástrico. Las partículas bien pequeñas pasan a cada lado de la válvula por unas depresiones laterales, los canales cardiacos inferiores. Estas partículas penetrarán luego en la glándula del intestino medio. 24 Algunas partículas pueden pasar más allá de la válvula cardio-pilórica y penetrar en la porción dorsal de la bolsa pilórica. Las más finas pasan a la glándula del intestino medio. Las más gruesas quedan retenidas por un filtro a la entrada de la glándula y son dirigidas posteriormente hacia el intestino (Álvarez,1998). 2.6.2.5 Contracciones del tubo digestivo Martínez (1999), afirma que en la región cardiaca ocurren contracciones rítmicas en una frecuencia de 1 cada 8-10 segundos. Estos movimientos están asegurados por la actividad de 12 neuronas. Los dentículos laterales, tienen movimientos rítmicos transversales que están bajo la dirección de 4 motoneuronas. La región pilórica tiene movimientos de contracción primero en la parte anterior y luego en la posterior. Estos movimientos sucesivos y coordinados aseguran la filtración y permiten la progresión del alimento hacia el intestino medio y posterior. Las contracciones son cada 1 a 2 segundos. El sistema nervioso estomatogástrico de los decápodos consta de un importante ganglio que inerva la parte anterior del tubo digestivo y controla dos redes neuronales: ¾ La que asegura la motilidad rítmica de los dentículos gástricos. ¾ La que asegura la motilidad rítmica de la región pilórica y que esta constituida por una docena de neuronas. Estas redes organizan por si solas toda la actividad motriz rítmica del intestino anterior. En el estómago es donde los alimentos ingeridos son transformados en una papilla líquida y es donde se produce la mayor parte de la digestión química de estos. 2.6.3 Degradación química de los alimentos Para la degradación química las enzimas digestivas provienen principalmente del 25 hepatopáncreas, el cual también es el principal órgano de absorción de los productos de digestión. Esta glándula esta formada de un sin número de túbulos ciegos que vierten sus productos de secreción al estómago. Las paredes de estos túbulos están constituidas por células de absorción, de depósito, secretoras, embrionarias y fibrilares. Las células secretoras o células B presentan un núcleo basal y grandes vacuolas del citoplasma llenas de material acidófilo que se coagula fácilmente. Estas células solo tienen una cantidad moderada de reservas en forma de lípidos, glucógeno y fosfato cálcico. Las células de absorción o células R captan los nutrientes en la luz de los túbulos de la glándula y sintetizan glucógeno y lípidos. Las células fibrilares o células F sintetizan las enzimas digestivas y las guardan como reserva en una vacuola supranuclear. Esta última se agrandará por pinocitosis, captando nutrientes de la luz tubular hasta originar una célula B típica. Las células B son las mas voluminosas de las células de la glándula cuando ellas están repletas. Contienen una vacuola central única que representa los 4/5 del volumen celular. En plena maduración de la célula B dicha vacuola comprime al núcleo contra la base de la célula. No se encuentran gránulos de glucógeno ni gotitas de lípidos en este tipo de células. Se piensa que la secreción es de tipo merocrino o apocrino en condiciones fisiológicas normales pero que, en caso de estimulación intensa la secreción puede ser halocrina. La expulsión de las secreciones de las células B podría deberse a las redecillas musculares de contracción que rodean la pared externa de los túbulos (Martínez, 1999). 2.6.4 Enzimas digestivas Álvarez, (1998) asegura que en particular existe una proteasa muy activa y de pequeña peso molécular (11,000 Dalton), esta enzima solo parece existir en decápodos y tiene un papel similar a la pepsina, estando esta última ausente de la glándula media. Pero se sabe de la existencia de varias proteasas en peneidos como Aztecus. Se han encontrado actividades 26 análogas a la tripsina y las carboxipeptidasas A y B, correspondientes a un peso molecular de 32,000 y algo mas. También se han evidenciado aminopeptidasas y dipeptidasas tras la separación cromatográfica o electroforética. La tripsina estudiada en el P. japonicus está constituida por 6 isoenzimas. Su peso molécular es de 25,000 Dalton. Ella solo representa más del 50% de las actividades proteásicas del hepatopáncreas en los Peneidos. En Palaemon serratus la quimiotripsina tiene una actividad media y aparece ya en la embriogénesis. La actividad quimiotrípsica evidenciada en varias otras especies generalmente es débil. En determinados crustáceos como el P. Japonicus, existe una débil actividad colagenolítica. Se han detectado en varias especies algunas enzimas capaces de hidrolizar el colágeno crudo. Existen enzimas que desdoblan glúcidos: amilasas, maltasas, sacarasas y celulasas. En Palaemon serratus se han encontrado la β-flucosaminadasa, β- gluxosidasa y la αglucosidasa. En la misma especie se han encontrado 3 glucoronidasas. También existen quitinasas que permiten la digestión de la quitina del exoesqueleto. La digestión de los lípidos esta asegurada por las lipasas y esterasas. Las lipasas actúan sobre los lípidos emulsionados y las esterasas continúan la digestión enzimática sobre los productos hidrosolubles obtenidos. También existen en los crustáceos los compuestos emulsificantes que desempeñan el mismo papel que la bilis de los mamíferos, o sea la de dispersar las grasas antes de su digestión. Tales compuestos están constituidos por derivados de la taurina y de los ácidos cólico y desoxicólico. Así mismo se han encontrado en crustáceos enzimas tales como la ribonucleasa, la desoxirribunucleasa y fosfatasas alcalinas. 27 El pH óptimo para la actividad de todas estas enzimas es variable y va desde 5.5 a 9. 2.6.5 Variación de las actividades enzimáticas digestivas 2.6.5.1 Variación a lo largo de la intermuda El ciclo de acumulación de reservas-consumo de reservas que caracteriza las variaciones fisiológicas debidas a la exuviación y a la formación de un nuevo exoesqueleto, esta estrechamente ligado a las actividades digestivas. Débiles en los estados iniciales, después de la ecdisis, las actividades aumentan durante los períodos de constitución de las reservas nutricionales, durante los estados más avanzados del ciclo. (Álvarez, 1998) 2.6.5.2 Variaciones circadianas A lo largo del ciclo circadiano, las actividades enzimáticas digestivas sufren variaciones importantes. En algunas especies como el P. japonicus y el Palaemon serratus se han determinado dos máximos: el primero se produce por la mañana y el segundo por la tarde, 12 horas después del primero. Trabajos recientes han establecido que el primer máximo es producido por el comienzo de la fase iluminada. El ritmo circadiano de las actividades enzimáticas digestivas no aparece en los primeros estadios larvarios, durante los cuales se pueden observar variaciones que son bastante irregulares. Algunas observaciones indican que la actividad enzimática aumenta de una a cuatro horas después del suministro de alimento. (Nolasco, 1998). 2.6.5.3 Variaciones durante el desarrollo larvario Álvarez, (1998) dice que el suministro de alimentos, cuya composición esté adaptada a sus capacidades fisiológicas digestivas. es de capital importancia. La composición del alimento debe corresponder a las actividades enzimáticas del tubo digestivo de las larvas y a su 28 evolución a lo largo de su crecimiento y desarrollo. En Palaemon serratus el crecimiento que es acelerado durante los primeros estadíos disminuye durante los últimos estadios larvarios y paralelamente se reduce la actividad de las enzimas, sobre todo las amilasas. La relación amilasas-proteasas aumenta desde Z1 a Z3, disminuyendo después de la metamorfosis y aumenta nuevamente enseguida. En P. japonicus la actividad enzimática aumenta durante los estadios metanauplios. La actividades amilásicas se multiplican por 15, mientras que en zoeas y misis éstas solo aumentan 5 veces. Las actividades enzimáticas digestivas son máximas durante el estadio misis; después disminuye hasta la metamorfosis en PL y aumenta de nuevo progresivamente. Todas estas variaciones ocurren al mismo tiempo que ocurre el cambio de regimenes alimenticios. Simultáneamente aparecen neurosecreciones provenientes del pedúnculo ocular en las especies antes mencionadas. Así mismo estas variaciones de las actividades enzimáticas están correlacionados con la concentración de ácidos. 2.6.5.4 Variaciones debidas al tipo de alimento y a factores ambientales Estas variaciones bioquímicas están en relación con la ecología y el comportamiento alimenticio de las especies estudiadas en su medio natural. Cuando se suministra a animales en cautiverio alimentos compuestos de baja proteína, sus actividades proteásicas son pequeñas. Conforme aumentamos la riqueza proteica las actividades proteasicas aumentan también hasta alcanzar un valor máximo. Después con contenidos proteicos mayores a 4445%, las actividades proteasicas disminuyen tanto mas cuanto mayor es la riqueza proteica del alimento. Un mecanismo similar ha sido encontrado para las amilasas siendo el porcentaje óptimo de glúsidos en el alimento (permite una actividad amilásica máxima) del orden del 6-8%. Las variaciones de salinidad afectan muy poco las actividades enzimáticas digestivas (Álvarez,1998). 2.7 La alimentación y nutrición del camarón Akiyama y Dominy, (1989), han realizado numerosas investigaciones sobre la nutrición del 29 camarón y afirman que los camarones crecen en aguas ricas en nutrientes, el cual se deriva tanto de fuentes vegetales (fitoplancton, algas) como animales (zooplancton, animales bentónicos). La fertilización química así como la orgánica, pueden incrementar la producción de organismos alimenticios aumentando de esta forma la capacidad de producción de organismos alimenticios aumentando de esta forma la capacidad de producción de camarón. Este sistema de cultivo de camarón con solo alimento natural puede ofrecer rendimientos de 200 a 500 Kg/Ha/cosecha. Los suplementos son una fuente de nutrientes, los cuales se utilizan para complementar el alimento natural con lo que se incrementa la capacidad de producción de camarón. Estos alimentos de bajo costo son peletizados y proveen principalmente de proteína y energía al sistema de cultivo. Este sistema de cultivo de camarón con suplementos, puede ofrecer rendimientos de 800 a 2,500 Kg/Ha/cosecha. En contraste con los suplementos, un alimento completo puede proveer todos los nutrientes conocidos para el camarón. Estos nutrientes pueden incluir proteína, aminoácidos, energía, lípidos y ácidos grasos, vitaminas y minerales. Estos alimentos complejos, son peletizados y no dependen del alimento natural para alcanzar un máximo de crecimiento, son mas caros que los suplementos. En estos sistemas de cultivo de camarón con alimentos completos se pueden producir por arriba de 20,000 Kg/Ha/cosecha . El uso de alimentos balanceados puede mejorar la producción de camarón e incrementar las utilidades. Sin embargo, los alimentos son caros y pueden variar del 50 al 70% del total de los gastos variables de producción. Como la calidad y el precio de los alimentos balanceados están directamente relacionados, una mejoría en la calidad del alimento aumentará invariablemente su costo. Por lo tanto, la calidad y el costo del alimento son factores críticos para determinar la rentabilidad de una granja camaronera. En la selección de un tipo apropiado de alimento de acuerdo al sistema de cultivo. Se necesita considerar varios factores. Estos incluyen la experiencia en el manejo de la granja, infraestructura existente, como bombas, arreadores, tamaño de la granja y del estanque, así 30 como la producción de camarón deseada. Todos estos factores se encuentran interrelacionados. Considerando que los costos fijos son altos, la disponibilidad de conocimiento técnico y la infraestructura de la granja, se puede alcanzar una producción elevada, requiriendo de un alimento complejo. Sin embargo, cuando los costos fijos son bajos y ni la experiencia técnica ni la infraestructura de la granja están disponibles, entonces un sistema de producción más económico con una producción más económica con una producción menor, puede ser el apropiado. En tal caso, un suplemento alimenticio puede ser suficiente. Un alimento completo puede ser demasiado caro y de calidad superior a las necesidades del productor. De aquí que la calidad del alimento deberá ser de un nivel apropiado al requerido por el sistema de cultivo. 2.7.1 Requerimientos nutricionales del camarón blanco Existen aproximadamente cuarenta nutrientes esenciales que se cree que son requeridos por el camarón. Estos nutrientes son provistos en diversos grados por los alimentos naturales y los suplementos. Dependiendo de la disponibilidad del alimento natural. Los niveles de los nutrientes pueden ser menores que los que se discutan. Por el contrario, si los camarones van a crecer en condiciones de cultivo por abajo del óptimo, los niveles de nutrientes requeridos serán mayores. Los requerimientos nutricionales discutidos son: 1) importantes a nivel granja; 2) toman en cuenta las diferencias entre las especies y 3) son requerimientos mínimos, en donde no hay alimentos naturales disponibles. (Akiyama y Dominy, 1989). 2.7.1.1 Proteína Las proteínas constituyen el principal material orgánico en los tejidos animales constituyendo del 65 a 75% del peso total en base seca. Como las proteínas son continuamente usadas para el crecimiento del camarón y el metabolismo normal, es necesario un suministro libre y continuo de proteínas. Una cantidad de proteínas inadecuada resulta en un crecimiento 31 reducido o en un cese del crecimiento, o en una pérdida de peso debido a la toma de proteínas de los tejidos para sostener las funciones vitales. Los niveles de proteína recomendados para alimentos comerciales, están enlistados en la tabla 3 si hay un alimento natural disponible estos niveles pueden ser reducidos. Tabla 3. Niveles recomendados de proteína en alimentos comerciales para camarón a. a TAMAÑO DEL CAMARÓN NIVEL DE PROTEÍNA g % 0.1-0.5 45 0.5-3.0 40 3.0-15.0 38 15.0-40.0 36 En base húmeda. Fuente: Akiyama y Chwang, 1989. Esta situación es especialmente cierta cuando se siembran inicialmente los estanques. A pesar de que el número de camarones sembrados sea alto, la biomasa real de camarones puede resultar baja. Por lo cual, la disponibilidad de alimento natural relativa a la biomasa de camarones puede ser considerable (Akiyama y Chwang, 1989) 2.7.1.2 Lípidos Los lípidos son un grupo de compuestos liposolubles formado por grasas y esteroles. Los lípidos son fuente de energía concentrada y de alta digestibilidad, componentes de los tejidos y acarreadores de vitaminas liposolubles. Los lípidos son indispensables para el funcionamiento y crecimiento normal del camarón. Los niveles de lípidos recomendados para alimentos balanceados, están enlistados en la tabla 4. Si existe alimento natural disponible, estos niveles de lípidos pueden ser reducidos. Un descenso en el crecimiento y un aumento en la mortandad están asociados con niveles de lípidos que exceden el 10%. Sin embargo, esto puede ser debido a un desbalance 32 nutricional y a deficiencias que se relacionen con la energía. Este argumento probablemente cambie conforme la información de los requerimientos nutricionales del camarón sea expandida. Tabla 4. Niveles recomendados de lípidos en dietas comerciales para camarón. a a TAMAÑO DEL CAMARÓN NIVEL DE LÍPIDOS g % 0.1-0.5 7.5 0.5-3.0 6.7 3.0-15.0 6.3 15.0-40.0 6.0 En base húmeda. Fuente: Akiyama y Chwang, 1989. 2.7.1.3 Fibra La fibra se refiere a la mezcla de celulosa, hemicelulosa, lignina, pentosas y otras fracciones generalmente indigestibles en el alimento. La fibra no es digerida en un nivel significativo para que sea un factor dentro de la nutrición del camarón. Los alimentos con alto niveles de fibra pueden incrementar la producción fecal y, consecuentemente, contaminar el agua ambiental. Los niveles de fibra en los alimentos comerciales para camarón no deben exceder del 4%. Esta limitante en fibra, incrementa significativamente el costo de la formulación alimenticia. Bajo sistemas de cultivo de camarón menos intensivos, los niveles de fibra pueden ser aumentados, reduciendo así el costo del alimento (Akiyama y Chwang, 1989). 2.7.1.4 Vitaminas Por definición las vitaminas son: a) Componentes naturales de los alimentos. 33 b) Son esenciales para el metabolismo. c) Su carencia en la dieta, provoca síntomas específicos (enfermedades deficitarias). d) No son sintetizadas por la mayoría de los animales. Los síntomas no específicos de las deficiencias vitamínicas son: a) Bajo crecimiento b) Pobre consumo c) Anorexia d) Color anormal e) Enanismo Es importante recalcar, que aunque son bien conocidas algunas enfermedades carenciales específicas, producidas por la falta de vitaminas en la dieta, existe también una variedad de signos que se presentarán, tan solo por las interrelaciones metabólicas entre ellas y otros nutrientes. Durante el crecimiento explosivo de la acuacultura en los últimos años, numerosos cambios en el concepto de suplementación vitamínica se han presentado. Por ejemplo: a) Los requerimientos de vitaminas se pueden buscar, en base a la minimización de la mortalidad, la ganancia de peso, la mayor concentración orgánica de tal o cual vitamina o bien la actividad enzimática óptima, respectiva a una vitamina como coenzima. b) La creciente tendencia de obtener ventajas por la comercialización de las especies acuáticas, cambia los requerimientos de los productos finales. En el caso de la conservación de los productos, numerosos trabajos reportan la eficiencia de la vitamina E, como agente para prevenir la oxidación de la carne y su enranciamiento, el cual produce malos olores y sabores. c) Algunas vitaminas como la colina tienen un efecto importante sobre el metabolismo de las grasas, como agente lipotrópico, mejora el intercambio de lípidos a nivel hepatopancreatico. d) El estrés puede ser contrarrestado por el uso de niveles altos de vitamina C. 34 e) Las altas suplementaciones de vitamina C y E, tienen un efecto importante en la estimulación del sistema inmune (Cortés, 1993). 2.7.1.5 Minerales Civera (1993) señala que los organismo vivos requieren elementos inorgánicos para llevar a cabo diversos procesos bioquímicos y fisiológicos. En efecto, los minerales intervienen en un gran número de funciones metabólicas como la construcción de tejidos, la osmoregulación y la respiración así como los cambios energéticos, activación de enzimas, etc. Algunos factores determinan la importancia de incluir minerales en las dietas de los crustáceos, como, la fuerte pérdida de minerales que sufren durante la muda (cerca del 90% de calcio), la poca abundancia de fósforo en el agua, la presión osmótica del medio y, en ciertas ocasiones la escasez de productividad natural que satisfaga plenamente los requerimientos alimenticios. Las cenizas se refieren a los elementos inorgánicos (minerales) en los alimentos. Existen aproximadamente 20 minerales que pueden ser requeridos por el camarón. El camarón puede absorber o excretar minerales directamente del ambiente acuático vía las branquias y la superficie corporal. Como el agua salobre usualmente contiene altos niveles de calcio, sin embargo, el nivel de calcio en los alimentos deberá ser monitoreado para mantener una relación calcio:fósforo de 1:1 a 1:5. El calcio no deberá exceder de 2.3% en los alimentos. Por otro lado, el fósforo es normalmente limitado en aguas salobres y necesita ser suplementado en los alimentos. Los niveles totales de fósforo en alimentos para camarón son de aproximadamente 1.5%. El nivel de cenizas en un alimento comercial no deberá exceder de 1.5%. esta limitante en cenizas ésta especificada para asegurar una cantidad mínima de nutrientes inorgánicos en el alimento. 35 2.7.2 Factores de calidad importantes del alimento balanceado para camarón 2.7.2.1 Atractabilidad y palatabilidad Un alimento balanceado nutricionalmente es de poco valor si no es consumido por el camarón. Por lo tanto, la atractabilidad y palatabilidad del alimento son críticas. Cuando el camarón es alimentado, los “atractantes” se liberan del alimento peletizado. Estos atractantes (aminoácidos) son detectados por el camarón por medio de quicio-receptores distribuidos a lo largo del cuerpo. De aquí que, el camarón se alimenta por el olor y no por la vista. El alimento con una buena atractabilidad podrá guiar al camarón hacia el. Cuando el camarón empieza a comer, el alimento debe ser palatable, para que el camarón pueda seguir comiendo sin interrupción (Civera, 1993). 2.7.2.2 Apariencia Como el camarón se alimenta por el olor, entonces el color del alimento es irrelevante. Sin embargo, el alimento para camarones deberá ser de un color uniforme. Variaciones en el color del un pellet indican un mezclado deficiente de los ingredientes y/o una variación en la cocción del alimento conforme este pasó por el dado de la peletizadora (Civera, 1993). Un mezclado deficiente resulta en una distribución heterogénea de los nutrientes en el alimento. Un “sobre-cocimiento” puede destruir muchos nutrimentos como vitaminas y aminoácidos y convertirlos en no disponibles. Un “sub-cocimiento” puede resultar en baja estabilidad en el agua. Los alimentos para camarón no deberán contener grandes cantidades de partículas de ingredientes; el camarón tiene la habilidad de separar las partículas grandes. Como los alimentos están formulados para ser balanceados, si las partículas grandes son removidas, el alimento consumido no será nutricionalmente adecuado. El tamaño desigual de la partícula es también indicador de un mal procesamiento. 36 El alimento no deberá mostrar fracturas y deberá ser uniforme en textura. Estas fracturas permitirán que el agua penetrara dentro del pellet reduciendo así su estabilidad en el agua. Los pellets no se deberán aglutinar entre sí. El aglutinamiento indica un secado inadecuado previo al ensacado o que se humedeció. La calidad nutricional del alimento húmedo se puede deteriorar rápidamente. Los alimentos para camarón deberán contener un máximo de 2% de finos o polvo. Un nivel excesivo de finos es resultado de un mal procesamiento y manejo. Estos finos resultan en un desperdicio del alimento debido a que no podrán ser consumidos por el camarón y pueden contribuir a un problema de contaminación en el agua (Akiyama y Chwang, 1989). 2.7.2.3 Estabilidad en el agua Akiyama y Chwang (1989), afirma que el alimento para camarón debe ser estable en el agua, ya que este es un consumidor lento y continuo, por lo que necesita mantener su integridad en el agua de manera que todo sea consumido; aquel que no sea estable en el agua y se desintegre rápidamente pueden resultar en desperdicio (mala conversión alimenticia) y contaminación del agua. La liberación de atractantes es necesaria para el consumo del alimento y todos los atractantes deberán liberarse en el curso de 1 a 2 horas. Si estos ya no se encuentran presentes no será consumido. Por lo tanto, se requiere una estabilidad en el agua por un mínimo de 2.5 horas. Sin embargo la estabilidad óptima en el agua es dependiente del manejo del alimento. Por ejemplo, si el camarón es alimentado varias veces (6 o más) al día, y en cada suministro todo se consume en el curso de 30 minutos, la estabilidad en el agua requerida podrá ser de solamente 1 hora. 37 2.7.2.4 Tamaño del pellet El tamaño del pellet para camarón no esta relacionado al tamaño de su boca. Sin embargo, el camarón necesita llevar partículas de alimento a su boca conforme se alimenta y frecuentemente nadarán con el pellet, por lo tanto, el pellet deberá ser suficientemente pequeño para ser llevado a la boca y permitir que el camarón nade con el. El camarón no requiere mas que de tres tamaños de alimento (Tabla 5), (Akiyama y Chwang, 1989). El camarón no requiere más de tres tamaños de pellet, sin embargo mientras mas pequeño sea el tamaño del alimento mayor cantidad de partículas de alimento por unidad de peso podrán estar disponibles, alimentando de esta forma a un mayor número de camarones. Debe haber un mínimo de 2.5 partículas por camarón durante cada distribución de alimento. Tabla 5. Tamaño recomendado para pellets de camarón. TAMAÑO DEL CAMARÓN (g) 0-3 TAMAÑO DEL ALIMENTO 1 mm ( migaja) 3-15 2 x 4 mm 15-40 2.5 x 5 mm Fuente: (Akiyama y Chwang, 1989). 2.7.3 Manejo del alimento El manejo del alimento es el factor más crítico para determinar la rentabilidad de una granja camaronera. Esto es debido al costo alto relacionado a la alimentación del camarón y a los efectos del alimento en las condiciones del cultivo, agua y calidad del sustrato. El manejo del alimento es muy objetivo ya que no se puede observar directamente. La observación atenta y la experiencia son elementos invaluables para mejorar la estrategia del manejo del alimento. 38 2.7.3.1 Estrategias convencionales de manejo del alimento Los camarones son consumidores intermitentes continuos nocturnos. este comportamiento de consumo indica la estrategia de manejo alimenticio. los camarones deben ser alimentados varias veces al día, la ración más grande se cree, debe ser administrada durante la noche cuando los camarones son más activos. Las tasas de alimentación más comúnmente aplicadas, así como los tiempos de alimentación y cantidad de alimento se presentan en la tabla 6 y 7. Según Akiyama y Chwang, 1989, una alimentación a las 02:00 horas sería benéfica pero no práctica. Las tasas de alimentación recomendadas y la cantidad de alimento deben usarse solo como guía. Tabla 6. Tasas de alimentación recomendadas por peso corporal por día. TAMAÑO DEL PROGRAMA DE PROGRAMA DE ALIMENTACIÓN CAMARÓN (g) ALIMENTACIÓN COMPLETA ( % ) SUPLEMENTARIA ( % ) 0-3 10-4 15-8 3-15 4-2.5 8-4 15-40 2.5-2 4-2 Fuente: (Akiyama y Chwang, 1989). Las tasas de consumo pueden ser calculadas y confirmados por medio de la siguiente fórmula, basada en el peso estimado del camarón y la tasa de sobrevivencia. Suministro de alimento diario = densidad de siembra X tasa de sobrevivencia X peso corporal del camarón X tasa de consumo alimenticio. Es difícil determinar con precisión el peso y la tasa de sobrevivencia de los organismos. El peso puede ser estimado por muestreo. Para este efecto se pueden pesar los camarones recolectados en las charolas de alimentación. De manera general no se muestrean durante las 3 ó 4 semanas iniciales del cultivo. Subsecuentemente, los camarones se muestrean semanalmente o por intervalos de 10 días. Es necesario establecer la curva de crecimiento, la cual servirá no solo para determinar la ración diaria de alimento, sino también para 39 estimar el estado de salud de los organismos. Las tasas de crecimiento se pueden ver afectadas tanto por la calidad del agua, como por la calidad del alimento. La tasa de sobrevivencia es casi imposible de determinar con precisión, durante la primera semana se asume que es del 90% debido al estrés provocado por la siembra. De ahí en adelante se reduce de manera homogénea durante cada semana hasta el momento de la cosecha. La impredictibilidad de la sobrevivencia subraya la necesidad de monitorear el alimento por consumo en lugar de calcular la ración (Akiyama y Chwang, 1989). Tabla 7. Horario de alimentación y porcentaje de la ración diaria en cada alimento empleada comúnmente. HORARIO PORCENTAJE DE LA RACIÓN DIARIA 06:00 20 10:00 10 14:00 10 18:00 30 22:00 30 Fuente: (Akiyama y Chwang, 1989). El manejo del alimento deberá estar regulado por el consumo. El apetito del camarón puede variar dependiendo de las condiciones ambientales tales como calidad del agua, días soleados o nublados y condiciones fisiológicas como enfermedades o muda. El consumo de alimento deberá ser monitoreado por medio del uso de charolas de alimentación o redes de observación. El número de charolas de alimentación por hectárea variará dependiendo de la habilidad del productor para monitorear el consumo. Generalmente se utilizan de 4 a 6 charolas alimentadoras por hectárea con un mínimo requerido de tres charolas por estanque independientemente del tamaño de este. La localización de las charolas es importante, ya que se deben evitar las áreas de enfrente de los arreadores, en donde el alimento y los atractantes se dispersan excesivamente por las corrientes (Akiyama y Chwang, 1989). 40 Aproximadamente de 1.5 a 2% del total del alimento suministrado por ración es colocado en cada charola. La cantidad de alimento por charola no debe exceder los 500 g. Todo debe ser consumido en el transcurso de 1 a 1.5 horas después de alimentar a los camarones mas grandes y después de 2 horas para los camarones juveniles (4 gramos o menos). Si todo es consumido en un tiempo menor que el indicado arriba, la tasa de alimentación debe ser incrementada. Ya que el incremento debe ser del 5% del total por ración en cada alimentación. El consumo del alimento puede variar con las condiciones del día debido a los factores ambientales o a las condiciones de los camarones, el consumo de alimento debe ser monitoreado en cada alimentación. Los alimentos manejados correctamente mejorarán la producción de camarón e incrementarán las ganancias. Es una mejor estrategia el alimentar un poco menos que lo requerido que sobrealimentar; ya que la sobrealimentación reducirá los beneficios e incrementará la mortalidad. El alimento no consumido incrementará la tasa de conversión alimenticia y por lo tanto, incrementará los costos de producción y disminuirán las utilidades (Akiyama y Chwang, 1989). El alimento no consumido representa un rubro importante, ya que contaminará el agua y el suelo. Estos factores causarán estrés en los camarones resultando en tasas de crecimiento reducidas e incrementando la susceptibilidad a las enfermedades y finalmente la muerte. Si los camarones son ligeramente subalimentados, éstos crecerán lentamente pero no morirán, por lo cual las tasas de conversión alimenticia TCA serán menores. Así la sobrealimentación de los camarones es un problema mas grande que la subalimentación. Akiyama y Chwang (1989), recomiendan las estrategias de manejo de alimento que minimizan la posibilidad de sobrealimentar, los niveles de alimentación se ajustan normalmente en base al consumo. Es importante que los aumentos en el nivel de alimentación se hagan de manera mas conservadora que las reducciones. Por ejemplo, si el alimento no es consumido totalmente dentro de los límites de tiempo estipulados, el nivel de alimentación se reduce para la siguiente distribución. Los aumentos de la ración se harán sólo después de 2 días consecutivos en los que todo el alimento fuera consumido. Otro ejemplo, seria ajustando los niveles, reduciéndolos en 10% o aumentándolos en sólo 5%. 41 Si los camarones se cultivan en agua de buena calidad, tendrán un mejor apetito, crecerán más rápido y tendrán mejores tasas de conversión. Sin embargo, al aumentar los niveles de alimentación afecta negativamente la calidad del agua. Con niveles de alimentación que excedan 50 Kg. de alimento/ha/día se requiere aireación artificial con el fin de mantener los niveles de oxígeno por arriba del umbral crítico. Si la calidad del agua es muy limitada, el nivel de alimentación deberá ajustarse de acuerdo a los niveles de oxígeno prevalecientes. Estos niveles deberán mantenerse por arriba de 4 ppm. Por debajo de este nivel de alimentación debe posponerse u omitirse. Esta situación se presenta generalmente al suministrar el alimento durante las primeras horas del día o bien ya tarde durante la noche (Akiyama y Chwang, 1989). Durante los períodos de estrés, los animales pierden apetito, subsecuentemente, la alimentación deberá reducirse u omitirse. Un buen manejo del alimento es especialmente crítico durante las últimas 8 semanas del ciclo de producción, en donde se consume más del 55% del alimento. Así la práctica de alimentación durante este período tendrá un mayor efecto en la TCA . Durante las 4 semanas iniciales del ciclo de producción sólo se consume 5% del alimento. Considerando que los animales son pequeños y se encuentran dispersos a través de todo el estanque, que el nivel de alimentación se fija en un solo nivel, esto es basándose en el área del estanque más que en el porcentaje de biomasa. El consumo de alimento también se ve afectado debido a cambios en las formulas del alimento y el tamaño de las partículas. Los organismos requerirán de varios días para ajustarse a estos cambios, por lo tanto, durante el período de transición en el cual se cambia el alimento, el alimento utilizado y el subsecuente deberán ser mezclados a una tasa de 50:50. La mezcla deberá utilizarse 2 días y de ahí en adelante se deberá ir adoptando la nueva ración de manera gradual. La TCA según Akiyama y Chwang (1989), es afectada además por el manejo del alimento y por la calidad de éste. Por ejemplo, un alimento puede ser de una calidad superior pero si es manejado incorrectamente, la TCA será muy alta. Este manejo se refiere al actual monitoreo 42 del consumo para minimizar el desperdicio. Por otro lado, mientras que el manejo del alimento puede ser excelente y la calidad del alimento inferior, la TCA podría mejorar. La evaluación de la calidad del alimento debe ser monitoreada por análisis de nutrientes, estabilidad y dureza de los pellets, atractabilidad, etc., mientras que el manejo del alimento es subjetivo. III. MÉTODO 3.1 Descripción del área La granja camaronera Santa Margarita S.A. de C.V., esta ubicada en el Municipio de Bácum, Sonora en el sistema estuarino La Atanasia-Santo Domingo y se localiza entre los 110°16’ y 110°13’ de longitud Oeste y los 27°08’ y 27°10’ de latitud Norte de acuerdo con la carta topográfica de la Comisión de Estudios del Territorio Nacional (CETENAL, 1982). Tiene un área aproximada de 200 Ha, esta formando una bahía y un sistema de canales sinuosos intercalados entre si, comunicándose al mar abierto por medio de dos bocas de 150 metros aproximadamente de ancho. 44 3.2 Sitio experimental El muestreo de los organismos de estudio se realizó durante un cultivo semi-intensivo comercial en los estanques de la granja acuícola Santa Margarita, S.A. de C..V., la cual tiene una extensión de 60 hectáreas y esta ubicada en la costa sur de Sonora. Los organismos experimentales fueron camarones blancos (Litopenaeus vannamei) juveniles y adultos, con un peso entre 4 y 42 gramos. El estudio de los organismos recolectados se realizó el los laboratorios de la Dirección de Investigación y Estudios de Postgrado (DIEP) del Instituto Tecnológico de Sonora (ITSON), en Cd. Obregón, Sonora, México. 3.3 Diseño del experimento El diseño experimental se basó en cuatro repeticiones del bioensayo llevados a cabo el 2425 de julio, 15-16 de agosto, 13-14 de septiembre de 2001. Las fechas anteriores coinciden en el ciclo lunar cuarto menguante. Se trabajo con dos tratamientos: camarones en ayuno y camarones alimentados; todos los camarones en experimentación fueron sometidos durante 48 horas a los tratamientos respectivos antes de dar inicio a los muestreos al azar (5 organismos) cada 2 horas durante 24 horas. Inmediatamente después del muestreo los organismos se colocaron en hieleras con geles congelados y se transportaron inmediatamente a los laboratorios de la DIEP y almacenados a -40°C en un ultracongelador, para su posterior análisis. 3.4 Preparación de los extractos enzimáticos Los organismos tomados en los muestreos al azar, fueron pesados en una balanza analítica OHAUS. Se llevó a cabo la disección de la glándula digestiva (hepatopáncreas, HP). La preparación de los extractos enzimáticos se llevo a cabo siguiendo la metodología propuesta por Galgani (1982), la glándula digestiva fue inmediatamente homogenizada en un mortero 45 con una solución amortiguadora de TRIS-HCl (50mM, pH 8.0), en una proporción de 1:4 (1 g de glándula digestiva por 4 volúmenes de TRIS-HCl). El extracto resultante se centrifugo a 8,500 rpm y la película lipídica fue retirada. Los sobrenadantes fueron considerados como extractos enzimáticos y almacenados en congelación a -40°C hasta su análisis. 3.5 Determinación de proteínas La determinación de proteínas de los extractos enzimáticos de glándula digestiva se llevo a cabo por el método de Bradford (1976). La mezcla de reacción consistió en 40 μl de extracto y 1.96 ml de reactivo de Bradford. Se agito en el vortex y posteriormente se leyó su absorbancia a 595 nm en el espectrofotómetro, utilizando albúmina sérica bovina como estándar. 3.6 Determinación de la actividad de la proteasa La actividad de proteasa digestiva en los extractos enzimáticos fue determinada de acuerdo a Hernández (1993), usando azocaseína como sustrato. La mezcla de reacción consistió en 20 μl de extracto, añadiendo 230 μl de TRIS-HCl (50 Mm, pH 8.0) y 500 μl de azocaseína (0.5% en Tris-HCl), 35°C para así iniciar la reacción. La mezcla se incubó durante 30 min a 35°C. La reacción fue detenida con 500 μl de ácido tricloroacético (TCA) (20%). Posteriormente se centrífugo a 8500 rpm durante 10 min; con el sobrenadante resultante se leyo la absorbancia a una longitud de onda de 440 nm. Una unidad de actividad de proteasa es definida como la cantidad de enzima requerida para incrementar 0.01 unidades de absorbancia a 440 nm por minuto. La actividad específica está representada en unidades de enzima por miligramo de proteína (U/mg). 3.7 Determinación de la actividad de la lipasa La actividad lipasa digestiva en los extractos fue determinada de acuerdo a Versaw y Cuppett (1989), usando como sustrato el β-nafthil caprilato. La mezcla de reacción contenía 46 50 μl de enzima (extracto), 50 μl de Tauracolato de Sodio (100 mM), 950 μl de Tris-HCl (50 mM, pH 8.0), preincubar, 5 min. a 35°C y para iniciar la reacción se añadieron 20 μl de Bnaphthyl caprylate (100 mM en DMSO), se dejó incubar, 30 min. a 35°C, posteriormente se agregaron 20 μl de Fast Blue BB (200 mM en DMSO) y nuevamente se incubó la reacción 5 min. a 35°C. La reacción se detuvo con 200 μl de TCA (0.72 N); se adicionó 2.71 ml de etanol:acetato de etilo (1:1 v/v), se agitó con ayuda de un vortex y se leyó la absorbancia a 540 nm. Una unidad de actividad de lipasa es definida como la cantidad de enzima requerida para incrementar 0.01 unidades de absorbancia a 540 nm por minuto. La actividad específica está representada en unidades de enzima por miligramo de proteína (U/mg). 3.8 Determinación de la actividad de la amilasa La determinación de la actividad de la amilasa se realizó de acuerdo a Vega-Villasante et al (1993), usando como sustrato almidón al 1% en TRIS-HCl (50 Mm, pH 8.0). La mezcla de reacción consistió en 5 μl de enzima (extracto), 495 μl de Tris-HCl (50 mM, pH 8.0), preincubar, 5 min, 35°C y agregar 500 μl de almidón (1% en Tris-HCl), 35°C, incubar, 10 min., 35°C posteriormente se agregó 200 μl de carbonato de sodio (2N) y 1.5 ml de ácido dinitrosalicílico (DNS) para parar la reacción y determinar los azúcares reductores resultantes de la hidrólisis del almidón. La mezcla se mantuvo en ebullición a baño maría, 15 min., se dejó enfriar y se agregan 7.3 ml de agua destilada, agitar y leer la absorbancia a 550 nm. Una unidad de actividad de amilasa es definida como la cantidad de enzima requerida para incrementar 0.01 unidades de absorbancia a 550 nm por minuto. La actividad específica está representada en unidades de enzima por miligramo de proteína (U/mg). VI. RESULTADOS Y DISCUSIÓN La actividad enzimática puede expresarse en diversas unidades como unidades por gramo de hepatopáncreas (U/g HP) o bien como actividad específica por miligramos de proteína (U/mg prot.). En este estudio se eligió expresar los resultados como actividad especifica U/mg proteína con el fin de poder realizar comparaciones con los resultados de otras investigaciones. Para establecer los picos de máxima y mínima actividad se consideran los resultados obtenidos al analizar a los camarones en ayuno ya que estos presentan una variación mas natural, sin la interferencia de la alimentación externa. En la gráfica 1 se observa el ritmo circadiano de actividad de la proteasa en camarones de 7 gramos y se puede ver un incremento en la actividad en los camarones que tuvieron estímulo alimenticio respecto a los que permanecieron en ayuno; se advierten además 2 picos de máxima actividad a las 18:00 (2.39 U/mg prot.) y 00:00 horas (2.63 U/mg prot.) y dos puntos mínimos a las 06:00 y 14:00 horas con niveles de 1.57 y 1.54 U/mg prot. 48 respectivamente, en camarones mantenidos en ayuno, además que la variación de la 5.00 4.50 4.00 3.50 3.00 2.50 2.00 1.50 18 :0 0 20 :0 0 22 :0 0 00 :0 0 02 :0 0 04 :0 0 06 :0 0 08 :0 0 10 :0 0 12 :0 0 14 :0 0 16 :0 0 ACTIVIDAD ESP. PROTEASA U/mg PROT actividad se nota mayormente cuando los camarones han sido alimentados. HORA ALIM ENTADOS AYUNO 16 :0 0 14 :0 0 12 :0 0 10 :0 0 08 :0 0 06 :0 0 04 :0 0 02 :0 0 00 :0 0 22 :0 0 20 :0 0 5.00 4.50 4.00 3.50 3.00 2.50 2.00 1.50 18 :0 0 ACTIVIDAD ESP. PROTEASA U/mg PROT Gráfica 1. Ciclo circadiano de actividad de la proteasa en camarones de 7 gramos. HORA ALIMENTADOS AYUNO Gráfica 2. Ciclo circadiano de actividad de la proteasa en camarones de 20 gramos. 49 La gráfica 2 muestra el ritmo circadiano de actividad de la proteasa en camarones de 20 gramos en la cual a diferencia de los camarones de 7 gramos ya no está tan marcada la diferencia entre la actividad de la enzima en situaciones de ayuno respecto a las de alimentación. Se observa un pico de máxima actividad localizado a las 08:00 horas con 16 :0 0 14 :0 0 12 :0 0 10 :0 0 08 :0 0 06 :0 0 04 :0 0 02 :0 0 00 :0 0 22 :0 0 20 :0 0 5.00 4.50 4.00 3.50 3.00 2.50 2.00 1.50 18 :0 0 ACTIVIDAD ESP. PROTEASA U/mg PROT nivel de 2.42 U/mg prot. y uno de actividad mínima a las 22:00 horas de 1.77 U/mg prot. HORA ALIMENTADOS AYUNO Gráfica 3. Ciclo circadiano de actividad de la proteasa en camarones de 25 gramos. El ciclo circadiano de actividad de la proteasa de camarones de 25 gramos se ve en la gráfica 3 en la cual se nota que nuevamente las gráficas de los camarones en ayuno y de los alimentados se cruzan en varios puntos, por lo que no es posible afirmar que hay un aumento en la actividad con el estímulo alimenticio. Se ven dos picos de mayor actividad a las 18:00 (3.01 U/mg prot.) y 10:00 horas (2.91 U/mg prot.); la variación de la actividad fuera de esos puntos máximos es mínima y fluctúa entre 2.0 y 2.5 U/mg prot. 5.00 4.50 4.00 3.50 3.00 2.50 2.00 16 :0 0 14 :0 0 12 :0 0 10 :0 0 08 :0 0 06 :0 0 04 :0 0 02 :0 0 00 :0 0 22 :0 0 20 :0 0 1.50 18 :0 0 ACTIVIDAD ESP. PROTEASA U/mg PROT 50 HORA ALIMENTADOS AYUNO Gráfica 4. Ciclo circadiano de actividad de la proteasa en camarones de 30 gramos. En el caso de los camarones de 30 gramos, la gráfica 4 muestra que la actividad de los camarones alimentados no se incrementa considerablemente respecto de los mantenidos en ayuno. La máxima actividad de la proteasa se alcanza a las 10:00 horas (3.07 U/mg prot.), con un mínimo a las 06:00 horas (1.96 U/mg prot.). Para establecer mejores relaciones se muestra en la gráfica 5 la actividad de la proteasa en camarones alimentados de las 4 tallas muestreadas. Es posible observar que no hay ninguna coincidencia en las variaciones pero los niveles de actividad se mantienen fluctuando sobre los mismos rangos (2.0 a 4.55 U/mg prot.). En los camarones mantenidos en ayuno, la gráfica 6 muestra que existe una ligera tendencia a aumentar la actividad enzimática respecto a la talla del camarón, a pesar de que la diferencia de tallas no es muy amplia. 16 :0 0 14 :0 0 12 :0 0 10 :0 0 08 :0 0 06 :0 0 04 :0 0 02 :0 0 00 :0 0 22 :0 0 20 :0 0 5.00 4.50 4.00 3.50 3.00 2.50 2.00 1.50 18 :0 0 ACTIVIDAD ESP. PROTEASA U/mg PROT 51 HORA 7g 20 g 25 g 30 g 5.00 4.50 4.00 3.50 3.00 2.50 2.00 1.50 18 :0 0 20 :0 0 22 :0 0 00 :0 0 02 :0 0 04 :0 0 06 :0 0 08 :0 0 10 :0 0 12 :0 0 14 :0 0 16 :0 0 ACTIVIDAD ESP. PROTEASA U/mg PROT Gráfica 5. Ciclo circadiano de actividad de la proteasa en camarones alimentados. HORA 7g 20 g 25 g 30 g Gráfica 6. Ciclo circadiano de actividad de la proteasa en camarones en ayuno. 52 Los picos de máxima actividad entre las diferentes tallas no siempre coinciden ni en los camarones en ayuno (gráfica 6) ni en los alimentados (gráfica 5), lo cual se puede deber según Reymond y Lagardere, (1990), a que los patrones de actividad, es decir el propio ciclo circadiano y las preferencias alimenticias cambian con la edad del camarón, ya que como afirma Wormhoudt, (1977), los ritmos circadianos pueden variar durante un ciclo anual. Con los resultados presentados en las gráficas 1,2,3 y 4, se ve que el camarón blanco, aún mantenido en condiciones de ayuno, presenta un ritmo circadiano en la producción de la proteasa. Como lo expresan Nolasco (1998), Clifford (1993) y Rodríguez, et al, (1979). El camarón blanco presentó un ciclo circadiano de producción de proteasa de al menos dos picos máximos de actividad específica como se observa en las Gráficas 1, 2,3 y 4, sin encontrarse diferencias entre el día y la noche como publican algunos autores en otras especies. Flores-Bravo (2000), estudiando juveniles de camarón café Farfantepenaeus californiensis, encuentra un comportamiento bifásico con mayor actividad enzimática de proteasas, amilasas y lipasas en horarios tarde-noche. En general el ciclo circadiano de producción de proteasas generales no se ve afectado grandemente por la alimentación externa, esto puede deberse a la disposición de altas cantidades de proteína contenidas en el alimento natural del estanque, las cuales son comparables a las que contiene el alimento balanceado. En cuanto a la actividad de la lipasa, en camarones de 7 gramos (gráfica 7), se nota un marcado incremento en la actividad lipásica de los camarones alimentados cuyas variaciones se encuentran en un rango de 100 a 160 U/mg de prot., respecto a los que fueron mantenidos en ayuno cuya actividad apenas se mantiene entre 40 y 90 U/mg prot., el punto de mayor actividad en este caso se encuentra a las 12:00 (88.48 U/mg prot.) y se ven dos mínimos a las 22:00 y 08:00 horas, con una actividad de 40 U/mg prot. 00 16 : 14 :0 0 00 12 : 00 10 : 00 08 : 00 06 : 00 04 : 02 :0 0 00 :0 0 22 :0 0 18 : 20 :0 0 220 200 180 160 140 120 100 80 60 40 20 00 ACTIVIDAD ESP. LIPASA U/mg PROT 53 HORA ALIMENTADOS AYUNO 0 :0 16 14 :0 0 0 12 :0 0 :0 10 08 :0 0 0 06 :0 0 :0 04 :0 0 02 0 00 :0 0 :0 22 20 :0 18 :0 0 220 200 180 160 140 120 100 80 60 40 20 0 ACTIVIDAD ESP. LIPASA U/mg PROT Gráfica 7. Ciclo circadiano de actividad de la lipasa en camarones de 7 gramos. HORA ALIMENTADOS AYUNO Gráfica 8. Ciclo circadiano de actividad de la lipasa en camarones de 20 gramos. 54 En los camarones de 20 gramos (gráfica 8), no se presenta el incremento en la actividad lipásica de los camarones alimentados, en la mayor parte del día se observan niveles similares de actividad excepto de las 22:00 a las 02:00 horas cuando la actividad de la lipasa en los camarones alimentados se incrementa notablemente; la actividad lipásica máxima la encontramos a las 16:00 horas (108.45 U/mg prot.) y la mínima a las 04:00 horas 0 :0 0 16 :0 14 :0 0 12 0 :0 0 10 :0 0 08 :0 0 06 :0 04 0 :0 0 02 :0 0 00 22 :0 20 :0 18 :0 0 220 200 180 160 140 120 100 80 60 40 20 0 ACTIVIDAD ESP. LIPASA U/mg PROT (43.51U/mg prot.). HORA ALIMENTADOS AYUNO Gráfica 9. Ciclo circadiano de actividad de la lipasa en camarones de 25 gramos. En la gráfica 9, se observa en los camarones de 25 gramos nuevamente un incremento en la actividad de la lipasa en camarones alimentados, excepto en un corto periodo entre las 18:00 y 22:00 horas en el cual los camarones alimentados presentaron un incremento; la actividad lipásica máxima se registra a las 18:00 (91.51 U/mg prot.) y la mínima a las 16:00 horas (51.73 U/mg prot.). 14 :0 0 16 :0 0 12 :0 0 08 :0 0 10 :0 0 04 :0 0 06 :0 0 00 :0 0 02 :0 0 22 :0 0 220 200 180 160 140 120 100 80 60 40 20 18 :0 0 20 :0 0 ACTIVIDAD ESP. LIPASA U/mg PROT 55 HORA ALIMENTADOS AYUNO Gráfica 10. Ciclo circadiano de actividad de la lipasa en camarones de 30 gramos. Los camarones de 30 gramos (gráfica 10), también presentan una incremento de actividad lipásica en la mayor parte del día para los camarones alimentados excepto a las 18:00 y a las 10:00 horas en las cuales los camarones en ayuno incrementaron su actividad; el máximo punto alcanzado por la producción de lipasa se ubica a las 18:00 horas (117.3 U/mg prot.) y el mínimo a las 06:00 horas (33.86 U/mg prot.). En la producción de lipasa se advierte más diferencia entre los niveles de actividad enzimática entre los camarones alimentados respecto a los mantenidos en ayuno, en comparación con el comportamiento que presento la proteasa en la cual básicamente los niveles son muy similares; esto puede ser debido a que la cantidad de lípidos dosificada por medio del alimento balanceado es considerablemente mayor a la que puede obtener del alimento natural del estanque. Para todos las tallas analizadas se registraron los puntos de mayor actividad entre las 16:00 y 18:00 horas, sin encontrarse ninguna diferencia entre el día y la noche. 220 200 180 160 140 120 100 80 60 40 20 18 :0 0 20 :0 0 22 :0 0 00 :0 0 02 :0 0 04 :0 0 06 :0 0 08 :0 0 10 :0 0 12 :0 0 14 :0 0 16 :0 0 ACTIVIDAD ESP. LIPASA U/mg PROT 56 HORA 7g 20 g 25 g 30 g 220 200 180 160 140 120 100 80 60 40 20 18 :0 0 20 :0 0 22 :0 0 00 :0 0 02 :0 0 04 :0 0 06 :0 0 08 :0 0 10 :0 0 12 :0 0 14 :0 0 16 :0 0 ACTIVIDAD ESP. LIPASA U/mg PROT Gráfica 11. Ciclo circadiano de actividad de la lipasa en camarones alimentados. HORA 7g 20 g 25 g 30 g Gráfica 12. Ciclo circadiano de actividad de la lipasa en camarones en ayuno. En la gráfica 11, es posible observar que para los camarones alimentados, no existe una concordancia en los picos de mayor actividad entre las diferentes tallas, así como tampoco 57 se advierte una relación entre los niveles de actividad y la talla de los camarones. Concordando en lo anterior con Reymond y Lagardere (1990), afirman que el ciclo circadiano cambia con la edad del camarón y con Van Wormhoudt (1974, 1977) indica que los ciclos circadianos de enzimas digestivas pueden variar durante un ciclo anual. La gráfica 12 ilustra lo expuesto anteriormente sobre la localización de los picos de mayor actividad lipásica en las 18:00 y 16:00 horas y que no existe relación alguna entre los niveles de actividad y las tallas del camarón, ni entre la actividad registrada entre el día y la noche, como lo afirma Flores-Bravo (2000) para camarón café. La actividad de la amilasa no pudo ser determinada ya que al parecer sufrió algún tipo de deterioro por las condiciones o el tiempo de almacenamiento. Las primeras muestras fueron analizadas 5 meses después de recolectadas y solo un mes después de preparar los extractos; Para emplear la técnica de determinación de la actividad amilásica anteriormente descrita, fue necesario hacer una dilución del extracto enzimático de 1:25, y se emplearon 5 μl de dicho extracto diluido, lo que indica una gran actividad de esta enzima; los análisis no se concluyeron en esa ocasión y fueron retomados 6 meses después de realizados los primeros análisis, durante ese tiempo los extractos fueron almacenados en un ultracongelador a –40°C, en esta ocasión no se detectó ninguna actividad por parte de esta enzima trabajando con el extracto diluido, por lo que fue necesario trabajar con el extracto concentrado y además aumentar hasta 100 veces mas la cantidad de muestra para detectar una mínima actividad en las mismas muestras que meses atrás habían demostrado una actividad muy elevada. Se comprobó que la técnica estaba bien aplicada, al analizar muestras frescas de camarón al mismo tiempo que los extractos congelador, y detectar una alta actividad en las primeras; lo anterior nos hace concluir que la amilasa sufrió algún tipo de deterioro durante su almacenamiento. V. CONCLUSIONES Y RECOMENDACIONES El camarón blanco Litopenaeus vannamei, aun en condiciones de ayuno, presenta un ciclo circadiano de producción de proteasa y lipasa de al menos dos picos máximos de actividad específica, durante el día. El ritmo circadiano de actividad proteásica no parece ser influenciado por el estímulo alimenticio externo y el ciclo circadiano de la lipasa si presenta un incremento en la actividad en los camarones alimentados. En los ciclos circadianos de actividad de proteasa y lipasa no se encontró diferencia alguna entre el día y la noche. Los picos de actividad enzimática de proteasa y lipasa en condiciones de ayuno y alimentados, no coinciden al incrementarse la talla del camarón. Hay una tendencia al aumento de la actividad proteásica con la talla del camarón, en camarones mantenidos en ayuno, lo cual es recomendable corroborar realizando estudios 59 con rangos mas amplios de edades, ya que la cercanía de las tallas manejadas no permitió observar claramente lo anterior. Cuando se realicen estudios para determinar la actividad amilásica general, es recomendable que las muestras sean analizadas lo mas pronto posible y es importante estudiar si existe un deterioro de esta enzima al someter a las muestras a congelación con técnicas tradicionales. BIBLIOGRAFÍA Abraham, B.G., F. Gendrop, A. Silva. 1997. Evaluación del crecimiento larval del camarón blanco L. vannamei bajo dos regímenes de alimentación. Oceanología. Vol. 1 pp. 71-72. Akiyama, D.M. y N.L.M. Chwang, 1998. shrimp feed requeriment and feed management. Procedings of the S.E. Asia shrimp farm management workshop. Singapore, pp.7582. ____________ y W.G. Dominy, 1998. Penaeid shirmp nutrition for the comercial feed industry. Texas shrimp farming manual, vol I, Texas, USA. pp. 1-50. Alfonso, E., L. Ramos. 1993. Manual del II curso internacional de producción de postlarvas de camarones peneidos del Atlántico de América. Cd. Campeche, México, p. 103. Álvarez, A. H., 1998. Fisiología de crustáceos y moluscos. Escuela Superior Politécnica del Mar. Guayaquil, Ecuador, pp 134. Avault, J.W. 1992. A review of world crustacean aquaculture: part one. Aquaculture Magazine, pp. 84-93. Bancomext.1999. Camarón Mexicano. Cultivo en granjas. México, pp.13 y 184. Barnes, D.R. 1993. Zoología de los invertebrados. Ed. Interamericana. México, D.F., p. 828. Bradford, M.M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analyt. Biochem. pp. 72, 248-254. CETENAL. 1982. Carta Topográfica Morelos II G12 B 43. Civera, C. R. 1993. Requerimientos minerales de crustáceos. Memorias del Primer Simposium Internacional de Nutrición y Tecnología de Alimentos para la Acuacultura., Monterrey, N.L. México, pp. 71-85. Clifford, H. C. 1993. El manejo de estanques camaroneros. Camarón 94. Seminario Internacional de cultivo de camarón, Mazatlán, Sinaloa, México. Cortés, J. E. 1993. Frecuencia y Distribución Alimenticia en el cultivo Intensivo de Juveniles de Camarón blanco L. vannamei . CICIMAR, La Paz, B.C.S. México, pp. 11-12,15,26 y 81-83. Cruz, S. L. E. 1996. Digestión del camarón y su relación con la formulación y fabricación de alimentos balanceados. Avances en Nutrición Acuícola III. Memorias del Tercer Simposium Internacional de Nutrición Acuícola. Monterrey, México, p. 213. Diagnosis of Shrimp Diseases, 1999. FAO and Multimedia Asia. 61 Flores, B. M.A. 2000. Estudio del ciclo circadiano de producción de enzimas digestivas del camarón café del Pacífico F. californiensis en cultivo. UABCS. México. pp. 1-65. Galgani. F. 1982. Etude des porteases digestives de crevettes peneides (crustaceadecapoda). Ph. D. Theis Université d’ Alx-Marseille 11. France, pp.70. Gómez, M. G., G. Escamilla, F.Molina. 1997. Producción de poslarvas de camarón blanco Penaeus setiferus en condiciones controladas en Tenabo, Campeche. Oceanología. Vol. 2. pp. 44-46, 79-80. Hernández, C., M. P. 1993. Crustacean proteasa characterization biochemical and molecular consideration. Comprehensive summary Ph D thesis. Centro de Investigaciones Biológicas del Noroeste, la Paz, B.C.S. México, p. 26. Holtschmit, K.H. 1999. Taxonomía del camarón. Industria Pesquera: Panorama Acuícola, Vol, 4. N. 6, pp. 20-22. IAES-SEDEPRO 2001. Directorio estatal de acuicultores 2001. Hermosillo, México, p. 42. Juárez, C.S. 1999. World Shrimp Markets 1999. Industria Pesquera: Panorama Acuícola. vol V. pp 8 y 12. Lobato, G.P. 1990. Estudio de los aspectos sociales que inciden en la difusión, asimilación y desarrollo de las tecnologías de cultivo de ostión en el Golfo de México y de cultivo de camarón en el Estado de Sinaloa. Proyecto SEPESCA/FAO/PNVD/MEX/87/018, p. 15. López, N. A. (1997). Primer Informe de Gobierno. Gobierno del Estado de Sonora. Martínez Cordova, R.L., 1999. Cultivo de camarones peneidos. Principios y prácticas. México. AGT editor, S.A, pp. 2-6. Mazón Suástegui, J.M. F. Magallon Barajas., G. Portillo Clark.1996. Cultivo de camarón penaeus spp . Estudio del potencial pesquero, pp.15-31. Nolasco, H. 1998. Actividad enzimática digestiva, ritmos circadianos y su relación con la alimentación del camarón. IV Simposium Internacional de nutrición acuícola. La Paz, B.C.S. México, pp. 1-15. Ocaña, S.R. 1991. Producción controlada de postlarvas de camarón; perspectivas y orientaciones nacionales para la actividad. Simposium internacional sobre laboratorios de postlarvas de camarón. SEPESCA. Mazatlán, Sinaloa, México, p.145. Orbe, A. y A. Arias. 1987. Métodos de cultivo del camarón en México. SEPESCA 2da. Edición. 29pp. Programa Agrario integral de Sonora (PAIS), 1989. Gobierno del Estado de Sonora. 62 Reymond, H., y J.P. Lagardere.1990. Feedin rhythms and food of Penaeus japonicus (Crustacea peneida) in salt marsh ponds: role of halophilic entomofauna. Aquaculture and Fisheries Management, 24: pp. 1-6. Rodríguez, D.,Van Wormhoudt and J.P. Legardere. 1976. Separation, properties, localization and nycthermeral variations of a DNAse a phosphodiesterase, a RNAse and an alkaline phosphase from the hepatopancreas of Paleamon serratus (crustacea Natantia). Comp. Biochem. Physiol. 54B: pp. 181-191. Shigueno, K. 1975. Shrimp Culture in Japan. 5a. Ed. Association for International; Technical Promotión, Tokio, Japon, p.15. Siri, Ch. M., P. Moctezuma. 1989. La pesca en Baja California. UABC. 7, pp. 79-83. Valdenebro, R. J. O.,1996. Viabilidad económica del cultivo de camarón café (L.californiensis) en el Noroeste de México. Tesis de maestria. UNISON. Hermosillo, Sonora, pp.13-17. Van Wormhordt, A. 1977. Activities enzimatiques digestives chez Palaemon serratus: Variations annualles de I’acrophase des rhytmes circadians. Biochemical Systematice and Ecology 3: pp. 301-307. _______________. 1974. Etudes des enzimes of I’hpatopancreas of Penaeus kurathurus Paleamon serratus, crustaceos decapodes dans les conditions physiolgiquess normales er in elevage. These of Doctoeur, Universite Aix Marseille France. P. 350. Vega Villasante, F., H. Nolasco, 1998. The activity of digestive enzimes during the multing stages of the arched swimming Callinectes arcuatus Ordway. Bolleting of marine science. 65: (1): pp.1-19. Versaw, W., S.L., D.D. Cuppett, 1989. An Improved Colorimetric Assay For Bacterial Lipase In Nonfat dry Milk. Journal of food science vol. 54 N, p. 5.