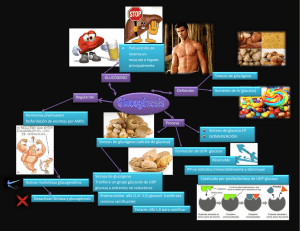
módulo sistemas metabólicos nutricionales
Anuncio

UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA MÓDULO SISTEMAS METABÓLICOS NUTRICIONALES POSTGRADO: ESPECIALIAZACIÓN EN NUTRICIÓN ANIMAL SOSTENIBLE. ESCUELA DE CIENCIAS AGRICOLAS PECUARIAS Y DEL MEDIO AMBIENTE. ECAPMA AUTOR: JAIRO GRANADOS. MSc. DOCENTE ECAPMA BOGOTÁ 2010 MÓDULO SISTEMAS METABÒLICOS NUTRICIONALES INTRODUCCIÓN La bioquímica metabólica es la ciencia que estudia todo lo relacionado con la actividad catalítica en las vías anabólica y catabólica de las diversas biomoléculas que forman parte de la dinámica celular de organismos animales y vegetales presentes en todo tipo de agro ecosistemas; por ende, permite comprender la estructura y cinética de los compuestos que intervienen en las diversas reacciones bioquímicas metabólicas aeróbicas y anaeróbicas. Además, teniendo en cuenta que es una ciencia teórico experimental la cual posee conceptos, leyes, principios y teorías científicas, se constituye en un pilar fundamental para la interpretación significativa de las múltiples reacciones biomoleculares que gobiernan los diferentes procesos exergónicos y endergónicos, enfocados a mantener las funciones vitales de sistemas autótrofos y heterótrofos, los cuales interaccionan permanentemente garantizando la bioactividad de los componentes de nuestro planeta. En consecuencia, la intencionalidad del curso se centra en la orientación adecuada de los estudiante de postgrado para que logren verdaderos aprendizajes significativos en los conceptos del metabolismo animal y vegetal, de tal forma que se promueva el desarrollo de competencias básicas en lo referente a la nutrición animal y vegetal, pilares fundamentales de los profesionales de las ciencias agrícolas pecuarias y del medio ambiente UNIDAD 1:CINÈTICA Y BIOTERMODINÁMICA METABÓLICA Capítulo 1:Equilibrio ácido base en monogástricos y rumiantes Las células animales y vegetales se consideran verdaderos sistemas metabólicos abiertos, debido a la interacción de un sinnúmero de procesos bioquímicos y termodinámicos que generan flujos de masa y energía hacia y desde el interior de las células mencionadas, estos procesos dependen también de factores cinéticos y moleculares que inciden en la velocidad con que ocurren las reacciones bioquímicas anabólicas y catabólicas, las cuales determinan las funciones vitales de un organismo vivo. Lección 1. Soluciones Amortiguadoras También se les denomina soluciones "Buffer" ó lampón y son aquellas que se oponen a los cambios de pH, cuando se les adicionan ácidos o álcalis (hidróxidos). su acción se basa principalmente en la absorción de hidrogeniones (H+) ó iones hidróxilo (OH').En forma general, una solución amortiguadora está conformada por una mezcla binaria de un ácido débil y una sal del mismo ácido proveniente de base fuerte ó también, una base y una sal de esta base proveniente de un ácido fuerte. Ejemplo: • Mezcla de ácido acético y acetato de Sodio • Hidróxido de amonio y cloruro de amonio La aplicación más importante de estas soluciones reside en el estudio de la regulación del equilibrio ácido=base en los sistemas biológicos, por eso a nivel de experimentos bioquímicos se utilizan para controlar el pH de reacciones in vitro. Un amortiguador biológico de vital importancia es el plasma sanguíneo, el cual regula valores de pH entre 7,2 y 7,3; con variaciones de 0,2 unidades se presentarían efectos letales para la vida. 1.1 pH de una Solución Amortiguadora Considerando que la solución amortiguadora es una mezcla de ácido débil con una sal del mismo ácido proveniente de base fuerte y además que un ácido débil se ioniza parcialmente, podemos representar la ionización de esta forma: HA <======> H+ + A- Aplicando la ley de acción de masas y teniendo en cuenta la constante de disociación se obtiene la siguiente expresión: pH =pKa + Log [A −] [HA] Donde pka,representa el valor del potencial de la constante de acidez del ácido débil, [A −] es la concentración del anión común,equivalente a la sal y [HA] indica la concentración del ácido débil que forma parte de la solución buffer.En consecuencia,la anterior ecuación se puede reescribir así: pH = pKa + Log [Sal ] [Ácido] Esta expresión se conoce como ecuación de Henderson -Hasselbach y sirve para calcular el pH de mezclas de ácidos débiles y sus sales es decir, soluciones "Buffer", Tampón ó amortiguadoras De acuerdo a esta ecuación, se puede deducir, que el pH de una solución amortiguadora, depende de dos factores: a)El valor del pKa del ácido débil b)Las proporciones entre Las concentraciones de sal y ácido 1.2 Capacidad Amortiguadora Se utiliza para comparar las eficiencias de las soluciones amortiguadoras y se define como: La cantidad en miliequivalentes(meq) de ácido o base fuerte que puede neutralizar la solución amortiguadora, sufriendo un cambio de pH en una unidad. Matemáticamente, se expresa como la relación cociente entre el incremento de ácido o base fuerte con respecto al incremento del pH, es decir: δ = Δ B / Δ (pH) Donde: δ = Capacidad amortiguadora de la solución Δ B = Incremento de ácido o base fuerte meq /(pH) Δ (pH) = incremento en unidades de pH Lo evidente es que esta capacidad, depende de dos factores: a) Concentraciones absolutas del sistema b)Proporción relativa de las formas disociada y sin disociar, siendo máxima cuando el cociente [sal]/[ácido] es próximo a la unidad. Lección 2. Sistemas amortiguadores fisiológicos El equilibrio ácido-base de las células está condicionado por un conjunto de sistemas amortiguadores, porque estas funcionan dentro de límites estrechos de pH a causa de su metabolismo. Los factores de amortiguación más sobresalientes en los organismos vivos, por su acción rápida y eficiente en la regulación del pH son: a. Sistema Bicarbonato b. Sistema Fosfato c. Hemoglobina d. Proteínas del plasma La importancia y relevancia de cada uno, depende del tipo de organismo.El mentefacto mostrado en La figura 1, resume las características, propiedades y clasificación de las principales soluciones amortiguadoras, presentes en lo organismos animales. Figura 1. características y tipos de amortiguadores biológicos en animales ÁCIDODÉBIL DÉBIL ++SAL SAL ÁCIDO Reguladores Reguladores depH pH de componentes Absorbenexceso exceso Absorben de iones H+ OHde iones H+ yyOHControlan Controlan metabolismo metabolismo ácidobase base ácido propiedades Solucionesbuffer buffer Soluciones (amortiguadoras) (amortiguadoras) ejemplos Regulanequilibrio equilibrio Regulan Homeostático Homeostático Bicarbonatos Bicarbonatos (HCO3-)-) (HCO 3 excluyen Fosfatos Fosfatos HPO=4 Ácidos fuertes (ácidos minerales) Lípidos y Carbohidratos Hemoglobina Hemoglobina HbH HbH Aminoácidos Aminoácidos (proteínas) (proteínas) De acuerdo a Miles y Butcher(1995),profesores de la Universidad de Florida, los amortiguadores (buffers) en los fluidos corporales sirven como una defensa contra el cambio del PH .Cada compartimiento de fluido contiene tipos y características de substancias disueltas, algunas que son amortiguadores a un pH fisiológico. Por eso, el pH es estabilizado por la capacidad amortiguadora de los fluidos corporales. En animales existen básicamente cuatro principales amortiguadores que se localizan en los tres diferentes compartimientos fluidos (Cuadro 1). Cuadro 1.Tipos de amortiguadores fisiológicos y ubicación en los fluídos biológicos FLUÍDO SISTEMA AMORTIGUADOR Bicarbonato Sangre Hemoglobina Proteínas Fosfatos Bicarbonato Extracelular y cerebroespinal Proteínas Fosfatos Proteínas Intracelular Fosfatos Bicarbonato Orina Fosfato Amoníaco Fuente: Miles y Butcher(1995) Como se puede observar, con excepción del amoníaco en la orina y la hemoglobina en la sangre, los amortiguadores en los compartimientos son idénticos. En consecuencia, el conocer como estas soluciones disueltas tienen la capacidad de amortiguar es esencial para poder entender al equilibrio ácido-base. Sistema Bicarbonato (anhídrido carbónico/bicarbonato) :Este el buffer amortiguador principal en el fluído extraceular, dentro de.la célula roja de la sangre y en el plasma. En este sistema el CO2 se comporta como ácido volátil y su concentración puede ser controlada por medio de la tasa de respiración del animal. La Siguiente ecuación muestra La formación de iones de hidrógeno en las células rojas de sangre como resultado del transporte del gas carbónico del tejido a los pulmones CO2 + H2O H2CO3 HCO3- + H+ Cuando la célula roja de sangre está dentro de los tejidos corporales esta reacción va hacia la derecha. En los pulmones la reacción va hacia la izquierda. Además, la presión parcial del CO, es más alta dentro del los tejidos y más baja en los pulmones. La reducción en la tasa de respiración permite la acumulación de CO2 y mueve la ecuación hacia la derecha,la concentración de hidrogeniones se incrementa y el pH del fluído se reduce, lo que produce una condición conocida corno acidosis respiratoria. Si la tasa de respiración es más rápida que lo normal, la ecuación se mueve hacia la izquierda y resulta la alcalosis respiratoria. Esto ocurre comúnmente en aves como resultado del jadeo debido al estrés por calor. Se puede controlar estos disturbios metabólicos, por medio de aumentar o reducir la tasa respiratoria. Sistema Fosfato: Todos los fosfatos en el animal vienen de la dieta, a un pH de 7.40, la mayoría del fosfato en los compartimientos fluídos existe en la forma de las especies iónicas H2PO4-1 y HPO4-2 , cuando el pH en los fluídos corporales comienza a decaer, la especie HPO4-2 se vuelve importante corno un aceptante de protones y se convierte en la especie H2PO4-1,así cuando el pH se eleva por encima de 7.40, la especie H2PO4-1 dona un protón al fluído y se convierte de nuevo en la especie HPO42. El sistema fosfatos es el amortiguador más importante en la orina,debido a que los protones excretados en la orina son principalmente en la forma de la especie H2PO4-1. Durante la acidosis prolongada, la amortiguación por fosfato es muy importante, lo cual se relaciona con los huesos,debido a que son una buena reserva de amortiguadores como el fosfato cálcico que se presenta en forma de hidroxiapatita,el cual no es muy soluble, pero su solubilidad es mayor durante la acidosis y algo de fosfato cálcico en los huesos se convierte en solución. Esto ocurre comúnmente en las ponedoras cuando los huesos están suministrando calcio para la calcificación del cascarón de huevo,entonces,el fosfato cálcico se disocia y se convierte en Ca+2 y PO4-3, inmediatamente la especie PO4-3 acepta un protón y se convierte en la especie HPO4-2. Durante la acidosis esta reacción continúa y la especie HPO4-2 acepta otro protón y se convierte a H2PO4-1. Así pues, durante la acidosis tos huesos...pueden ayudar a mantener el e.quilibrio ácido-base por medio proporcionar la especie de fosfato que acepta protones, incrementando el pH al nivel desead 7,4 Hemoglobina : La hemoglobina es un amortiguador muy importante y sólo so encuentra en la célula roja de la sangre. Sirve como un amortiguador excelente por varias razones. Las dos razones principales son su alta concentración en la sangre y su altísimo contenido del aminoácido histidina. Este aminoácido tiene una cadena lateral única llamada imidazol. Esta cadena , puede atraer a los protones y sacarlos de los fluidos corporales o puede donar protones dichos fluidos en el intento de mantener el pH cerca de 7.40. Las otras proteínas en los compartimentos de fluído, también le deben su capacidad de amortiguar a esta cadena lateral. La albúmina es la proteína del plasma más abundante y contribuye en forma significativa a la amortiguación de la sangre. El fluido intracelular está lleno de proteínas que funcionan como el sistema más importante de amortiguación dentro de la célula.En condiciones metabólicas la Hb se comporta como un ácido débil y la oxihemoglobina como un ácido más fuerte que la Hb reducida (es decir aquella que lleva un hidrogenión —> HHb). Es importante anotar, que la Hb incide sobre el transporte del CO2 por la sangre, veamos como lo hace:En las células por efecto de la respiración celular se produce gas carbónico que pasa a la sangre penetrando los hematíes, quienes contienen la enzima anhidrasa carbónica y convierten al CO2 en ácido carbónico (H2CO3), este se disocia en iones bicarbonato e hidrógeno, que harían descender el pH, de no ser capturados rápidamente por la HbO2~, que se transforma en oxihemoglobina reducida(HHbO2). Lección 3. Metabolismo ácido base en animales. El equilibrio ácido-base del organismo animal está localizado en los compartimentos líquidos. El agua representa aproximadamente el 60% del peso vivo de un animal adulto y se distribuye en el líquido intracelular (alrededor del 60% del agua total) y el líquido intersticial, con un 7 a 8% del agua total formando el agua plasmática (Meschy F.,2000) Gráfica 1.Composición química de los fluídos corporales (Tomado de Meschy.,2000) La gráfica 1, muestra la importancia del potasio, sodio, cloro y bicarbonato que tienen un papel esencial en el mantenimiento del equilibrio iónico y por ende del metabolismo ácido-base, ya que el proceso bioquímico de su regulación pasa por los sistemas tampón o de intercambio iónico.po lo tanto, la ingestión de agua o de electrolitos desplaza este equilibrio y puede traducirse en cambios temporales del tamaño de los compartimentos líquidos. La relación que existe entre electrolitos y equilibrio ácido-base se basa en los mecanismos de absorción digestiva y los intercambios iónicos entre los compartimentos digestivos y sanguíneos. La absorción de cationes se hace “en contra” de los iones H+ y tiene, por tanto, un efecto alcalinizante a nivel sanguíneo, mientras que la absorción de aniones tiene un efecto inverso debido a la salida de iones bicarbonato de célula sanguínea. El mantenimiento del equilibrio ácido-base dentro de los valores fisiológicos pone en juego un sistema principalmente localizado a nivel sanguíneo (poder tampón de los hematíes y del plasma) y renal. La hipótesis clásica de compensación de la acidosis metabólica (Pitts, 1948) considera que el pH plasmático y la concentración en bicarbonato sanguíneo se mantienen en los valores normales por dos vías complementarias a nivel renal: • Reabsorción del bicarbonato en el tubo proximal del riñón ; en situación de acidosis la casi totalidad del bicarbonato filtrado a nivel glomerular es rápidamente reabsorbido; • Salida de protones por acidificación intensa en el tubo distal . Esta acidificación puede hacerse por dos vías: la del fosfato, generalmente admitida, y la del catabolismo de la glutamina, hoy en día cuestionada (Atkinson y Bourke, 1995), que no conduciría a la producción de amoníaco sino directamente ión amonio, sin acción sobre el equilibrio ácido-base en esa zona de pH. Igualmente, es preciso tener en cuenta la importante producción iónica derivada del metabolismo de los aminoácidos o la utilización del bicarbonato en la ureogénesis. El pH de la orina es ciertamente un indicador fiable (Patience, 1990) y sobre todo de más fácil determinación que el pH sanguíneo o la concentración de bicarbonatos en plasma. Lección 4: Balance electrolítico dietario (BED) Un electrólito es una substancia que cuando se disuelve agua produce una solución de átomos disueltos o iones con cargas eléctricas. Por ejemplo NaCl se disocia en solución y se vuelve a Na+1 y Cl-1 y cuando KHCO3 se disocia en solución se convierte en K+ y HCO3-1. . Las dietas de animales no tienen ninguna carga eléctrica neta,por eso, todos los aniones con carga eléctrica negativa están balanceados con los cationes de carga positiva. De la misma manera, en todos los fluidos biológicos la suma de la carga positiva tiene que ser igual a la suma de la carga negativa. Los electrólitos pueden tener diferentes efectos sobre el metabolismo y la fisiología y por eso pueden afectar al equilibrio eléctrico y consecuentemente al equilibrio ácido-base y al desempeño del animal. Enfermedades tales como enteritis resultan en una pérdida de electrólitos,en consecuencia,se tienen que tomar medidas, como la suplementación de electrólitos, para compensar los perdidos.El equilibrio de electrólitos es la diferencia entre la concentración total de aniones y cationes dietéticos,así, los elementos minerales en la dieta que tienen una carga eléctrica negativa se consideran elementos que forman ácidos y recíprocamente los elementos que forman bases tienen una carga positiva . La idea de manipular las concentraciones iónicas de la ración a fin de evitar las consecuencias patológicas de la acidosis (o de la alcalosis) es bastante antigua y encontró en los años 70 un primer campo de aplicación en avicultura. En rumiantes, la primera aproximación ha sido para la prevención de la fiebre de la leche; más recientemente han aparecido un cierto número de trabajos relacionados con la especie porcina. La base es bastante simple: los aniones, a excepción del fosfato y del bicarbonato, son acidógenos y los cationes son alcalógenos. Según el esquema de Monguin(1981),el comportamiento de los electrolitos y equilibrio ácido-base es: (An-Cat)in = acidez ingerida, donde: An:aniones y Cat:cationes (An-Cat)or = acidez excretada AEndo = acidez endógena En estado de equilibrio : (An-Cat)in + AEndo - (An-Cat)or = 0 Sobre esta base, se han propuesto varias ecuaciones, para monogástricos, se mantiene generalmente el Balance Electrolítico (BED) expresado en mEq/kg de MS (ó por 100 g) de alimento.Esto se puede representar de la siguiente forma: BED =meq (Na+ + K+ - Cl-)/Kg dieta También: BED = (Na/23 + K/39 - Cl/35,5) x 1000 Con todo rigor, sería preciso probablemente tener en cuenta otros aniones y cationes con la condición de que no sean metabolizados, es decir iones exclusivamente destinados a la homoestasis ácido-base, y debería ser tenida en cuenta su eficacia de absorción digestiva. Así, otras ecuaciones para rumiantes (Horst et al., 1997) y porcinos han sido propuestas (Patience y Wolynetz, 1990), sin que por el momento supongan una mejora sensible . Lección 5. Aplicaciones del balance electrolítico(BED) en animales. Los primeros estudios sobre los efectos del equilibrio electrolítico de la ración sobre los rendimientos fueron realizados con aves en los años 70. Sauveur y Mongin(1978) encontraron una respuesta curvilínea de la velocidad de crecimiento cuando el BED aumentaba, siendo el crecimiento máximo para un BED de alrededor de 250 mEq/kgEstos mismos autores también demostraron la existencia de una relación estrecha entre la acidosis metabólica, caracterizada por un bajo contenido deL anión bicarbonato: HCO3- en el plasma, y la mayor frecuencia de discondroplasia tibial Después de una docena de años, estudios similares han sido realizados con la especie porcina. El destete se de un cambio brutal de la naturaleza y del modo de presentación del alimento consumido por los lechones, los cuales necesitan una rápida adaptación de su función digestiva. En particular, la acidificación del alimento en el estómago debe ser suficiente para controlar el desarrollo de la flora bacteriana (E. Coli) y permitir una actividad óptima de las enzimas digestivas. En el destete, esta acidificación es difícil debido a la que la actividad secretora es pequeña y a que el poder tampón de los alimentos (resistencia a la acidificación) es mucho más importante que el de la leche (Bolduan et al., 1988). El poder tampón de los alimentos, definido como la cantidad de HCl necesaria para bajar el pH a 3 (Boltshauser et al., 1993) ó 4 (Bolduan et al., 1988)y depende principalmente de su contenido en proteínas y minerales. Paralelamente, también depende del balance electrolítico de la dieta. Un poder tampón pequeño del alimento corresponde a un valor bajo de BED. En la práctica, se recomienda utilizar durante este período (0-2 semanas postdestete) alimentos que presenten un bajo poder tampón (Bolduan et al., 1988). Si bien el efecto sobre el pH estomacal no ha sido claramente demostrado, la utilización de ácidos orgánicos ha resultado ser interesante durante este período, sobre todo cuando la dieta no contiene productos lácteos (Easter, 1988 ; Giesting et al., 1991). Sin embargo, es preciso destacar que estas dietas con bajo poder tampón son igualmente acidógenas a nivel metabólico, lo que podría tener una incidencia negativa sobre los rendimientos. Algunos trabajos han estudiado las posibles interacciones entre la adición de ácidos orgánicos y de bicarbonato sódico (Krause et al., 1994, Giesting et al., 1991). En dichos trabajos, los rendimientos óptimos generalmente se obtienen cuando la adición de ácidos orgánicos está asociada a la incorporación de bicarbonato de sodio Capítulo 2 : BIOACTIVIDAD DE ENZIMAS EN NUTRICIÓN ANIMAL Leccción 1: Características de las enzimas Son proteínas y por lo tanto, cualquier proceso que altere su estructura, como por ejemplo: El calentamiento excesivo, adición de ácidos o bases fuertes, las desnaturalizan, perdiendo su actividad biológica y catalítica. Las enzimas son biocatalizadores de origen proteíco, altamente especializados, esto significa que actúan casi siempre sobre una sola reacción o determinado tipo de sustancias llamadas sustratos. Así existen enzimas que hidrolizan únicamente almidones y se llaman amilasas, otras hidrolizan grasas y se denominan lipasas. En general, el nombre de la enzima depende de la sustancia sobre la que actúa y que se llama sustrato.Sin las enzimas no podrían ocurrir actividades metabólicas como la respiración, la contracción muscular, el crecimiento, la actividad cerebral o la digestión. Al igual que los catalizadores inorgánicos, las enzimas no se destruyen durante el proceso y porque su acción se limita a activar el sustrato, disminuyendo así la energía de activación que necesita éste para transformarse en un producto determinado. 1.1 Clasificación de las enzimas Como se afirmó anteriormente, las enzimas son catalizadores altamente especializados, esto significa que actúan casi siempre sobre una sola reacción o determinado tipo de sustrato; así existen biocatalizadores que hidrolizan únicamente almidones y se llaman amilasas, otras hidrolizan grasas y se denominan lipasas. En general, el nombre de la enzima depende de la sustancia sobre la que actúa, es decir, el sustrato, su clasificación se da con base en el tipo de reacción catalizada, como se muestra en el siguiente cuadro: Cuadro 1. Clasificación de los diversos tipos de enzimas GRUPO TIPO DE REACCIÓN CATALIZADA Òxido -reductasas Reacciones de òxidoreducción Transferasas Transferencia de grupos funcionales orgánicos Deshidrogenasa succínica Catalasas Transaldolasas Aciltransferasas Hidrolasas Hidrólisis en presencia de agua. Carbohidrasas Celulasas Liasas Adiciòn al doble enlace Descarboxilasas Pirùvico descarboxilasa Ligasas Unión de moléculas utilizando ATP. Glutamina sintetasa polimerasas Isomerasas Reacciones de isomerización Triosa isomerasa Fructosa isomerasa EJEMPLOS EJEMPLOS: aisomerasa GLUCOSA-6-P ⎯fosfohexos ⎯⎯⎯ ⎯ ⎯→ FRUCTOSA-6-ISOMERASA Pirùvico carboxilasa ÀCIDO PIRÚVICO ⎯⎯ ⎯ ⎯ ⎯⎯→ ÀCIDO OXALOACÈTICO ureasa H2N-CO-NH2 +3 H2O ⎯⎯ ⎯→ 1CO2 + 2NH4OH 2H2O2 ⎯catalasa ⎯⎯→ 1O2 + 2H2O Otras reacciones bioquímicas enzimáticas(RBE) que son importantes en el metabolismo animal son: • En la glucólisis o ruptura de la glucosa sanguínea, la primera reacción es catalizada por una ligasa denominante Hexoquinasa. GLUCOSA + ATP Hexoquinasa GLUCOSA-6-FOSFATO +ADP +H • La enzima alcohol deshidrogenase (una óxido-reductasa) convierte en el hígado, el alcohol etílico, antes de que llegue al cerebro, en acetaldehído, el cual es usado por la célula para sintetizar grasas. Lección 2. Mecanismo de reacción de las enzimas El mecanismo de una reacción bioquímica enzimática(RBE),está relacionado con las diferentes etapas que sigue el sustrato, para transformarse en producto. Dicho mecanismo, fue propuesto por los doctores Leonor Michaelis y Maud Menten(1913).y se muestra en la siguiente ecuación: E+S K1 K2 (E--S)* K3 P+E Esto implica que el enzima libre (E) puede captar en su centro activo una molécula de sustrato (S), transformándose en el complejo activado enzima sustrato (ES)*, este complejo puede evolucionar de dos formas: a)Libera el sutrato y regenera la enzima libre, cuando no alcanza la suficiente energía de activación,es decir, invierte su reacción. b) Transforma el sustrato en un producto final y regenera la enzima libre de acuerdo a la cinética K3, cuando supera la barrera energética inicial. Lección 3. Factores que afectan la cinética enzimática Las reacciones químicas catalizadas por enzimas, dependen del pH, la temperatura, el efecto de la concentración de la enzima y de la concentración del sustrato. A continuación, se analiza cada factor: a) Efecto del pH Debido a que las enzimas son de naturaleza proteica, las alteraciones en el pH del medio modificarán profundamente el carácter iónico de los grupos aminos y carboxilos de los aminoácidos que constituyen la proteína y en consecuencia afectarán su poder catalítico. Es decir, a valores extremos de pH se produce una inactivación de la enzima. Por lo tanto, es importante establecer m pH óptimo en estudios enzimáticos, en el cual, la actividad catalítica de la enzima presenta un rendimiento alto, conociendo este valor, la reacción se debe mantener en este rango de pH por medio de un buffer o solución amortiguadora, lo mismo ocurre en la célula, ya que un pequeño cambio en el valor de pH produce también graves efectos sobre la actividad enzimática, incidiendo como es obvio en el metabolismo del animal. V Vmáx Ph óptimo pH La gráfica anterior nos muestra que cuando se modifica el pH en el transcurso de una reacción enzimática, aparece un valor en el cual la velocidad es máxima, este punto se denomina pH óptimo y por encima o debajo de dicho valor, la velocidad disminuye. b) Efecto de la Temperatura Al igual que el pH, las temperaturas extremas, afectan las reacciones enzimáticas, dada su naturaleza proteica. Debido a esto, se observa que a diversas temperaturas, la velocidad de la reacción cambia, tal como lo demuestra la ecuación de Arrhenius. Sin embargo, a un cierto valor la velocidad de la reacción es máxima, lo cual nos indica una TEMPERATURA ÓPTIMA de la misma, por encima o por debajo de esta temperatura la enzima pierde actividad y la velocidad disminuye, tal como lo indica la figura 2 C) Efecto de la Concentración de la Enzima La velocidad de una reacción enzimática varía, directamente proporcional a la concentración de la enzima, por lo tanto a mayor [E] se incremente la velocidad, esto es válido en presencia de un exceso de sustrato. d) Efecto de la Concentración del Sustrato Sí mantenemos la concentración de la enzima constante y variamos la concentración del sustrato, podemos observar que cuando se aumenta la concentración de éste, inicialmente hay un incremento notable en la velocidad de la reacción, hasta alcanzar una velocidad máxima estable, después de la cual permanece invariable por más sustrato que se le agregue. La curva hiperbólica de la figura nos muestra que a baja concentración de sustrato la relación entre V y [S] es prácticamente lineal y por lo tanto obedece a una cinética de primer orden con respecto al sustrato, es decir: V =[ K] A medida que se incrementa la concentración de sustrato se llega a una zona donde se presenta una mezcla cinética de primer y segundo orden, finalmente, llega a una región donde la velocidad es máxima, constante e independiente la concentración del sustrato, aquí la cinética es de orden cero y no se modifica, poque la enzima ya está saturada en sus centros activos con el sustrato, también observamos que en el punto medio de la velocidad máxima aparece siempre una concentración de sustrato fija, denominada constante de Michaelis, la cual se relaciona con la afinidad de la enzima por el sustrato.El anterior análisis, nos indica que la cinética enzimática está caracterizada por dos factores fundamentales: La velocidad máxima (Vmáx.) de la enzima y la constante de Michaelis (Km) L a ecuación cinética de esta gráfica hiperbólica es: V Sus parámetros cinéticos, se pueden explicar así: a. LA VELOCIDAD MÁXIMA (Vmáx) de una reacción enzimática es el límite de la velocidad cuando la concentración del sustrato tiende al infinito y es causada por la saturación de los centros activos de la enzima por el sustrato. b. LA CONSTANTE DE MICHAELIS (Km) es la concentración del sustrato en el cual la velocidad de la reacción enzimática es la mitad de su velocidad máxima. Lección 4. Cinética enzimática de Michaelis. Los estudios sistemáticos del efecto de la concentración inical del sustrato sobre la actividad enzimática comenzaron a realizarse a finales del siglo XIX. Ya en 1882 se introdujo el concepto del complejo enzima-sustrato como intermediario del proceso de catálisis enzimática. En 1913, Leonor Michaelis y Maud Menten , desarrollaron esta teoría y propusieron una ecuación de velocidad que explica el comportamiento cinético de los enzimas. Para explicar la relación observada entre la velocidad inicial (v0) y la concentración inicial de sustrato ([S]0, Michaelis y Menten propusieron que las reacciones catalizadas enzimáticamente ocurren en dos etapas: En la primera etapa se forma el complejo enzima-sustrato y en la segunda, el complejo enzimasustrato da lugar a la formación del producto, liberando el enzima libre: En este esquema, k1, k2 y k3 son las constantes cinéticas individuales de cada proceso y también reciben el nombre de constantes microscópicas de velocidad. Según esto, podemos afirmar que: v1 = k1 [E] [S] v2 = k2 [ES] v3 = k3 [ES] Se puede distinguir entre enzima libre (E) y enzima unido al sustrato (ES), de forma que la concentración total de enzima, [ET], (que es constante a lo largo de la reacción) es: [ET] = [E] + [ES] Como [E] = [ET] - [ES], resulta que: v1= k1[S] [ET] - k1 [S] [ES] Además, como [ES] es constante, la velocidad de formación de los productos es constante: v = v3 = k3 [ES] = constante. Como v1=v2+v3, podemos decir que: k1[S] [ET] - k1 [S] [ES] = k2 [ES] + k3 [ES] Despejando [ES], queda que: , en donde la expresión (k2+k3)/k1 se ha sustituído por KM, o constante de Michaelis-Menten. Este enlace nos aporta una explicación sobre las razones que hacen de la KM un parámetro cinético importante. Para cualquier reacción enzimática, [ET], k3 y KM son constantes. Vamos a considerar dos casos extremos: • A concentraciones de sustrato pequeñas ([S] << KM) v = (k3 [ET]/KM) [S]. Como los términos entre paréntesis son constantes, pueden englobarse en una nueva constante, kobs, de forma que la expresión queda reducida a: v = kobs [S], con lo cual la reacción es un proceso cinético de primer orden. • A concentraciones de sustrato elevadas ([S] >> KM), v = k3 [ET]. La velocidad de reacción es independiente de la concentración del sustrato, y por tanto, la reacción es un proceso cinético de orden cero. Además, tanto k3 como [ET] son constantes, y nos permite definir un nuevo parámetro, la velocidad máxima de la reacción (Vmax): Vmax = k3 [ET], que es la velocidad que se alcanzaría cuando todo el enzima disponible se encuentra unido al sustrato. Si introducimos el parámetro Vmax en la ecuación general de la velocidad, obtenemos la expresión más conocida de la ecuación de Michaelis-Menten: V Hay enzimas que no obedecen la ecuación de Michaelis-Menten. Se dice que su cinética no es Michaeliana. Esto ocurre con los enzimas alostéricos, cuya gráfica v frente a [S] no es una hipérbola, sino una sigmoide . En la cinética sigmoidea, pequeñas variaciones en la [S] en una zona crítica (cercana a la KM) se traduce en grandes variaciones en la velocidad de reacción. Lección 5. Enzimas exógenas en la nutrición animal(Granados et al.,2000) Las enzimas son proteínas de estructura tridimensional sumamente comple ja. Actúan sólo en condiciones definidas de temperatura, pH y humedad y únicamente con substratos específicos (Btihler y colaboradores, 1998). El uso comercial de enzimas en nutrición avícola, empezó hace algunos arios con la aplicación de Beta-glucanasas en dietas a base de cebada, debido a su bajo contenido energético y pobre digestibilidad, por la presencia de Beta-Glucanos, los cuales forman soluciones de elevada viscosidad en el intestino de las aves, interfiriendo así con la correcta digestión y difusión de los nutrientes de la ración alimenticia (Sorensen y Nielsen., 1998). La utilización de enzimas en dietas balanceadas para aves, ha demostrado contribuir a] mejoramiento de su comportamiento productivo en factores como: conversión alimenticia, ganancia de peso y eficiencia en razón al aumento de la degradación de los componentes antinutricionales de los piensos, basados principalmente en cereales como: cebada centeno y trigo. El efecto antinutritivo de la cebada se atribuye principalmente al 1,3 - 1,4 Betaglucano, porque su porción soluble es mucho más elevada que la de los pentosanos,(Buhler y colaboradores., 1998). Estos Betaglucanos son parecidos a la celulosa y están conformados por moléculas de glucosa unidas entre sí por enlaces Beta-glucosídicos 1, 4 y 1, 3. Estos son los que originan la intensa ramificación y la posibilidad de acumulación de agua, que tiene un efecto antinutritivo por aumento de la viscosidad. El contenido de betaglucanos en la cebada oscila entre 15 y 107 g/kg de materia seca (Bühler et al.,1998). Otros componentes de la cebada, difíciles de digerir, son el ácido tífico y sus sales denominadas Fitatos. Dichas sales son ésteres del ácido hexafosfórico del inositol y pueden formar complejos insolubles con proteínas y cationes divalentes como calcio, magnesio, Zinc y cobre. Esto reduce la biodisponibilidad de estos nutrientes, haciéndolos difícilmente digeribles. En consecuencia, el fitato es un factor antinutritivo en la dieta (Basf., 1997). El contenido de fósforo tífico en la cebada tiene un rango de 2.2 gramos a 2.9 gramos por cada kilogramo de materia seca (Bubler et al.,1998). Las sales del ácido fitico ó fitatos, sólo pueden descomponerse por acción de las fitasas que no están presentes de forma natural en el tubo digestivo de las aves de corral. Estas enzimas., son producidas en el laboratorio por fermentación microbiana a partir del Aspergillus niger y son utilizadas en animales monogástricos para degradar los fitatos, incrementando con ello la biodisponibilidad del fósforo y otros componentes nutricionales de la dieta (Vahan., 1997). La fitasa cataliza una reacción de defosforilación del fitato a través de un mecanismo no definido (Hurtado y Resende., 1997). El producto enzimático más utilizado en la producción de pavos es la fitasa. Fancon (1997), utilizó esta enzima con 13 mil 280 pavos de las variedad But Big; observó que se produjeron algunos efectos beneficiosos en los parámetros productivos especialmente, en la ganancia de púa y el índice de conversión. Vahan (1997), encontró que esta enzima además de mejorar la digestíbilidad del fósforo, incrementaba también la digestibilidad del nitrógeno de los componentes de la dieta, aumentando los rendimientos de carne y la velocidad de crecimiento. Teniendo en cuenta que las enzimas permiten hacer uso de materias primas poco utilizadas en la alimentación aviar, se decidió evaluar el efecto de la suplementación de las enzimas: carbohidrasas, complejo (arabanasa + celulosa + betaglucanasa + hemicelulosa xilanasa) y fitasa, en una ración alimenticia enriquecida con cebada y su incidencia en el comportamiento productivo de gallopavos. Capítulo 3: Biotermodinámica LECCIÓN 1: Introducción a la termodinámica La termodinámica es la ciencia que estudia las relaciones entre calor y las demás que formas transformación de transferencias biofisicoquímica de implica, energía, puesto generalmente, un toda cambio energético. Para abordar el estudio de la termodinámica es necesario revisar los conceptos de Temperatura y Calor. 1.1 Temperatura (T) La temperatura puede definirse como la propiedad termodinámica que cuantifica la energía cinética molecular promedio de las moléculas existentes en cualquier sistema,además, determina el flujo de calor y el equilibrio térmico,así, dos cuerpos están a la misma temperatura si no hay transferencia de calor cuando se colocan juntos. 1.1.1 Escalas de Temperatura La más importantes son: La Celsius o centígrado (°C), kelvin(K), Farenheit (°F) y la Rankine(°R) La siguientes ecuaciones muestran la correspondencia matemática entre las escalas: K= °C + 273 °F=1,8°C +32 °R = °F + 460 1.2 Calor (Q) El calor como propiedad termodinámica es una forma de transferencia de energía debida a la diferencia de temperatura(∆T), entre dos sistemas,es decir, es energía en tránsito que depende de T1 y T2. Teniendo en cuenta el concepto de calor específico, como la cantidad de calor(Q) que se debe suministrar a unidad de masa (m) para elevar la temperatura en 1 grado (∆T),se tiene que la ecuación fundamental del calor es: Q= mCP ∆T Donde: Q = calor ganado o perdido por el sistema m = masa de la sustancia en gramos C p= calor específico de la sustancia,medido a presión constante, en cal/g°C ∆T= T2 -T1 T2 = Temperatura final del sistema T1= Temperatura inicial del sistema Para efectos de resolver algunos ejercicios,se debe tener en cuenta los siguientes factores de conversión: Cuadro 1:Tipo de unidades y factores de conversión para masa y energía. UNIDADES CONVERSIONES 1g=1000mg , 1kg=1000g ; MASA 1lb=454g 1kg=2,2 lb ; 1tonelada(t)=1000kg 1cal=4,18J ; 1kcal=4,18KJ CALOR , TRABAJO Y ENERGÍA 1kcal=1000cal ; 1KJ=1000J 1MJ =106J; 1Mcal =106 cal 1BTU=252 cal g=gramos ; mg=miligramos ; lb=libras ; cal=calorías ; Kcal=kilocalorías ; J=Joule KJ=kilojoule ; MJ=Megajoule ; BTU=British thermal unit 1.2.1 Calor de Combustión (Energía Bruta) Cuando una sustancia orgánica se quema por completo hasta sus últimos productos de oxidación, gas carbónico (CO2), agua(H2O) y otros gases, el calor liberado se denomina energía bruta o calor de combustión y se expresa como la variación de la entalpÍa (∆H) en Kcalorías por mol. Ejemplo: Para la Glucosa : ∆H = 673 Kcal/mol, lo cual indica que cuando 1 mol de glucosa, es decir 180g, se oxidan completamente hasta CO2 y H2O, se generan 673 kilocalorías. Esta medida es importante para determinar el contenido energético de los alimentos, que el organismo utiliza y su determinación se efectúa en una bomba calorimétrica. A nivel de nutrición animal es útil expresar la energía bruta en Kcal/ g. Ejemplo: Para el Salvado de trigo : ∆H = 4,54 cal/g, esto significa que cuando 1 g de salvado de trigo se oxida completamente, existe una liberación de 4,54 calorías o 19 Joules. LECCIÓN 2: Postulados fundamentales de la termodinámica 2.1 Primera Ley Enunciada por Robert Meyer en 1841, es el principio de la conservación de la energía y puede definirse así: La energía total de un sistema aislado permanece constante, es decir, la energía no se crea ni se destruye, sólo se transforma de un tipo a otro. Por lo tanto, cuando desaparece una clase de energía debe producirse una cantidad equivalente de otra clase. Cualquier cambio en el estado del sistema, incluye un cambio en la energía interna (∆E) igual a la cantidad de calor (Q) absorbida por el sistema menos la cantidad de trabajo (W) realizado por el mismo, esto se puede escribir así: ∆E = Q - W Teniendo en cuenta, que el calor es una forma de energía, fácilmente cuantificable, la mayor parte de las investigaciones sobre las equivalencias e intercambios de energía que tienen lugar en los procesos fisicoquímicos fueron analizados con base en los cambios caloríficos de un sistema termodinámico. La energía Interna(∆E), se define como la capacidad intrínseca de un sistema para producir trabajo, incluye todas las formas de energía y resulta del movimiento de las moléculas, la atracción intermolecular y otros factores fisicoquímicos. ∆E es una función termodinámica de estado, porque depende únicamente de los estados inicial y final del sistema, esto significa que es independiente de la tayectoria de una transformación, así el calor de combustión de la glucosa se puede determinar por incineración ó a nivel metabólico. En un organismo animal, ocurren un múltiples reacciones bioquímicas que constituyen el metabolismo bioenergético. Esta serie de reacciones, se subdividen en 2 categorías básicas: el catabolismo, que implica la desintegración de macromoléculas en otra más sencillas y el anabolismo, que se refiere al proceso inverso, es decir, a la síntesis o formación de productos bioquímicos destinados a la estructura del protoplasma celular. En toda esta cadena de procesos químicos, se requiere en mayor ó menor cantidad la energía, por lo tanto, es importante pensar ¿De dónde se pro duce?, ¿Cómo se produce?, ¿en dónde se almacena?, ¿cómo se utiliza?. Para dar respuesta a esta serie de interrogantes, comenzaremos por afirmar que la energía utilizada, es extraída gradualmente de los alimentos (carbohidratos, lípidos y proteínas) a través de tres etapas fundamentalmente oxidativas: Hidrólisis, formación de Acetil CoA y ciclo de Krebbs con la fosforilación oxidativa, los productos finales de estas etapas son el gas carbónico, agua y lo más importante: ENERGÍA, La cual es almacenada en una molécula extraordinaria: El ATP ó Adenosín Trifosfato. 2.2 Segunda ley de la Termodinámica La primera ley de la termodinámica, no establece la dirección de flujo del calor, ni tampoco clarifica sus efectos de éste sobre el sistema y sus entorr Debido a esto, los eminentes científicos Rudolf J.E. Clausius, lord Kelvin y > Planck, trataron de generalizar estos conceptos, para así, darle el sentido a las transformaciones termodinámicas. Con base en sus trabajos experimentales llegaron a los siguientes enunciados. a. Primer enunciado (Según kelvin-Planck): No es posible diseñar una máquina térmica capaz de convertir todo el calor absorbido en trabaje. Esto significa que la eficiencia o rendimiento de las máquimas térmicas en menor del 100%. b. Segundo enunciado (Según Clausius): El calor fluye espontáneamente de un foco más caliente a un foco más frío y no viceversa. De estos enunciado, puede deducirse lo siguiente: - Todos los procesos de la naturaleza tienden a cambiar espontáneamente en una dirección que conduzca al equilibrio. - El calor no se transforma en trabajo, sin producir cambios permanentes en los sistemas o sus proximidades. - La energía se degrada. Ejemplo, sí calentamos previamente una barra de hierro y luego la aislamos el calor no se concentrará únicamente en un extremo, sino que se distribuirá uniformemente en toda la barra, marcando la dirección de flujo de calor desde el punto más caliente hasta el extremo más frío. 2.2.1 Características de la Entropía(∆S) a. La entropía puede considerarse como la medida del desorden de un sistema termodinámico. b. En un proceso reversible la entropía global no cambia, es decir ∆S = O, porque ésta depende únicamente de los estados inicial y final del sistema. c. En todo proceso irreversible la entropía total aumenta, luego ∆S > O d. A una temperatura dada, los sólidos tienen una entropía relativamente baja, los líquidos una cantidad intermedia y los gases la entropía más alta. e. Al aumentar la temperatura, la entropía y el desorden crecen. f. En general, se puede afirmar que la entropía del universo va en aumento ya que la mayoría de los procesos termodinámicos son irreversibles. g. Cuando los organismos vivos se desarrollan, disminuyen su entropía (∆S<0), por causa del orden estructurado de la materia viva. Pero el descenso se produce a expensas de un incremento entrópico del medio ambiente. h. En un sistema, la energía útil está organizada y cuando se utiliza en realización de un trabajo se convierte en calor, que es una forma de energía, basada en el movimiento caótico de átomos y moléculas, por lo tanto, incrementa el desorden del sistema y por consiguiente la entropía. En síntesis, podemos afirmar que todo proceso natural se realiza con un incremento entrópico y que la dirección del cambio es aquella que conduce a tal aumento. Este enunciado es la forma más general de la segunda ley de la termodinámica, luego los otros casos indicados son formas particulares de esta ley. LECCIÓN 3. Energía libre metabólica (∆G) y equilibrio Debido a que el cambio entrópico, no es fácilmente medible en una reacción bioquímica, el profesor Josiah.W. Gibbs , propone una función termodinámica de estado, que relaciona el cambio de entalpía (∆H) y el cambio entrópico del sistema a presión y temperatura constantes, la cual se denomina Energía Libre de Gibbs (∆G) La ecuación básica es la siguiente: ∆G =(∆H) - T(∆S) Esta ecuación de gran aplicación en bioquímica, puesto que combina la primera y segunda leyes de la termodinámica, proporcionando información valiosa acerca de la espontaneidad, sentido y estado de equilibrio de una reacción bioquímica. 3.1 Características de ∆G a. La energía libre de Gibbs mide la energía necesaria que necesita un sistema para realizar un trabajo útil. b. La energía libre del Gibbs es la fuerza impulsora de las reacciones bioquímicas enzimáticas(RBE) c. Sí el cambio en la energía libre es negativo la RBE se produce espontáneamente, por lo tanto, se dice que es exergónica, catabólica libera energía. d. Sí el cambio en la energía libre es positivo la RBE no se produce espontáneamente, por lo tanto, se dice que es endergónica, anabólica y requiere el suministro de energía para que ocurra. e. Sí el cambio en. la energía libre es cero (0), el sistema está en equilibrio, y no se produce ninguna reacción(RBE) De esto se puede concluir, que una reacción química RBE, se produce, siempre y cuando disminuya la energía libre de Gibbs, es decir ∆G<0. Figura 2.Rutas catabólicas de la glucosa y producción de energía. C6 H12 O6 + 6O2 6 CO2 + 6 H20 ; ∆G= - 2.866 kJ/mol (686 kcal/mol) Vistas aisladamente las reacciones bioquímicas son de dos tipos: unas que liberan energía al producirse y otras que consumen energía. Las reacciones que liberan energía son llamadas reacciones exergónicas y en ellas ∆G es negativo; las reacciones que consumen energía para producirse son endergónicas y ∆G es positivo. Por ejemplo, la reacción de oxidación de la glucosa es exergónica, porque libera energía. C6 H12 O6 + 6O2 6 CO2 + 6 H20 ; ∆G= - 2.866 kJ/mol (686 kcal/mol) No debemos confundir el cambio energético de una reacción con la liberación de calor. Si señalamos la liberación de calor en esta reacción, pondríamos más (+); sin embargo, como lo que representamos es el cambio energético, ∆G tiene signo negativo (-), que expresa lo que le sucede a la reacicón, o sea, pierde energía. Quiere esto decir que el segundo miembro de la ecuación tiene 2866 kJ(686) kcal) menos que el primero y la reacción en su conjunto se desplaza hacia la derecha. La fijación del CO2 , realizada en las plantas, es endergónica, que consume energía, y ∆G en este caso es positiva. Como es lógico suponer, las reacciones exergónicas deben ir acompañadas obligatoriamente de otra reacción que libera la energía necesaria para que se produzca la reacción endergónica. De forma que visto el proceso en su conjunto y como una sola reacción, estas serían de tipo exergónica. Igualmente, al considerar todas las reacciones que ocurren en un momento dado en un organismo animal como una sola, sería de tipo exergónico , liberadora de energía. Así debemos considerar también el metabolismo; por un lado reacciones de síntesis (anabolismo), que consumen energía y por otro lado reacciones de degradación (catabolismo) que liberan la energía necesaria para las primeras y donde siempre la energía liberada tiene que ser mayor que la consumida. Lección 4. ATP, Cofactor energético El adenosín trifosfato ó trifosfato de adenosina(ATP),es considerada como una biomolécula energética, con alto potencial de transferencia de grupos fosfato y Cuyo papel fundamental es el de transportar la energía libre(∆G), de las reacciones bioquímicas enzimáticas metabólicas(RBEM). Dicha biomolécula tiene tres componentes básicos: Una base nitrogenada púrica denominada:Adenina ,un monosacárido pentosa llamado ribosa y tres grupos fosfatos enlazados mediante enlaces químicos fosfoanhídridos de éster,los cuales almacenan y transportan la energía metabólica. La estructura de la molécula,se muestra a continuación(Lehninger.,2000) Figura 3. Estructura molecular del ATP(Lehninger.,2000) Es así como el enlace del último radical fosfato contiene unas 7300 calorías por mol, lo que significa que cuando éste se rompe por hidrólisis, se deben liberar 7300 calorías por mol, es decir: ATP + H2O <======> ADP + Fosfato + 7300 calorías Esta energía química del ATP la utiliza la célula en su trabajo biológico, transformándola en energía mecánica, eléctrica, térmica y por último en calor La reacción anterior es reversible, lo cual indica, que para formar una molécula de ATP, debe presentarse la reacción entre el ADP(Adenosín difosfato) y una molécula de fosfato, con un suministro de 7300 calorías por mol, por lo tanto, este proceso consume energía. Es importante el análisis cuantitativo de esta energía producida en un organismo animal, por eso, su valoración se fundamenta principalmente en el calor desprendido o liberado por éste, en una bomba calorimétrica o calorímetro de respiración, con este aparato, se lleva cuenta del ingreso de alimentos, agua y oxígeno, de la excreción de sólidos, líquidos, gases y la producción de calor. Esta medición se denomina calorimetría directa y sirve para efectuar un balance energético en la nutrición animal, es decir, el análisis de energía metabolizable, energía neta y energía nutritiva total, esenciales en el estado nutricional del animal. La energía utilizada, es extraída gradualmente de los alimentos (carbohidratos, lípidos y proteínas) a través de tres etapas fundamentalmente oxidativas: Hidrólisis, formación de Acetil CoA y ciclo de Krebbs con la fosforilación oxidativa, los productos finales de estas etapas son el gas carbónico, agua y lo más importante: ENERGÍA. La cual es almacenada en una molécula extraordinaria: El ATP Lección 5 Flujo y tipos de energía en los animales. La fuente primaria de toda la energía utilizada por los animales, las plantas y todos los organismos vivos del planeta está en la energía liberada por el sol. Esta es captada por las plantas en el proceso de la fotosíntesis, con la formación de cadenas carbonadas (glucosa, ácidos grasos, aminoácidos, etc.) que conservan dicha energía y de donde posteriormente los animales la obtienen para suplir sus necesidades. Todas las complejas funciones del organismo animal son realizadas por medio de la energía. Así, el trabajo celular, la biosíntesis, el trabajo osmótico, el trabajo mecánico y demás funciones orgánicas, son posibles gracias a la energía, la cual toma de los productos ingeridos, que al ser oxidados en el organismo animal, liberan la energía contenida en ellos. En los animales superiores la temperatura se mantiene constante a 37° Celsius, esto hace que no se pueda utilizar el calor como fuente de energía para realizar el trabajo. Sin embargo, los animales realizan trabajo; la razón de ello es que la energía producida en las reacciones química a nivel celular es captada en forma de energía química y utilizada posteriormente para el trabajo celular. En este aspecto el ATP juega un importantísimo papel como transportador de toda la energía química requerida en todas las reacciones del metabolismo. Su formación, a partir del ADP y el fósforo inorgánico, está acoplada a la degradación de las moléculas que actúan como combustibles y que liberan la energía requerida para ello. Posteriormente el ATP libera su energía la cual es usada para todo el trabajo celular. Tal es el ciclo que se establece entre las plantas y los animales y el papel del ATP como intermediario en los intercambios de energía a nivel celular, tanto en las plantas como en los animales. El ciclo energético en su conjunto incluye los siguientes aspectos: 1. La fotofosforilación. Es decir, la captación de la energía de las radiaciones solares en los cloroplastos de las plantas verdes y su transformación en energía química en forma de ATP. 2. La utilización de la energía química del ATP para la formación de sustancias orgánicas tales como glúcidos, lípidos, aminoácidos, etc., por los vegetales, donde a partir del CO2, y del H2O, se forman las cadenas carbonadas que serán posteriormente utilizadas por los animales. 3. La respiración celular en las mitocondrias de las células de los animales, donde estos productos son oxidados a CO2, y H2O liberando su energía que es utilizada para la síntesis del ATP (fosforilación oxidativa). 4. La utilización de la energía del ATP formado para realizar todo el trabajo celular, que incluye el trabajo químico o biosintético (síntesis de proteínas, glúcidos, lípidos, y otras biomacromoléculas ). 5.1Tipos de energía en los animales. A partir de los aspectos antes analizados, sobre todo el flujo de energía en la naturaleza y el sistema representado por la cadena respiratoria y la fosforilación oxidativa, se comprende el papel de la energía dentro del metabolismo. Es importante señalar que toda la energía requerida por un sistema metabólico debe estar presente y por supuesto suministrada por el entorno. Es decir, los animales requieren del suministro constante de energía la cual obtienen de los productos alimenticios ingeridos y los vegetales del sol. La energía contenida en los alimentos ingeridos recibe el nombre de energía bruta (EB) y se obtiene por combustión completa del alimento en base a materia seca. La energía bruta de un alimento está dada por la relación que contenga de carbohidratos, proteínas, grasas y otros compuestos orgánicos. Un gramo de carbohidrato produce por combustión 4.10 kcal, un gramos de proteínas 5,65 kcal y un gramo de grasas 9,45 kcal. Como es lógico el incremento de proteínas y sobre todo de grasas en la composición del alimento aumenta el valor energético de los mismos. Estos conceptos son muy aplicados en nutrición animal para establecer diferentes tipos de dietas. Si a la energía bruta (EB) le descontamos la energía perdida por las heces (EF) debido a los alimentos sin digerir, así como, a las secreciones del aparato digestivo, restos celulares, microbios entéricos, etcétera, se obtiene la energía digestible (ED). La energía digestible depende del coeficiente de digestibilidad de la ele la dieta lo cual se debe fundamentalmente a la composición química su solubilidad y posibilidades de hidrólisis, por las enzimas el aparato digestivo de cada especie animal. La energía digestible varía mucho en dependencia del alimento y es un concepto de mayor utilidad que el de energía bruta. Si de la energía digestible descontamos la energía urinaria, debido a productos absorbidos no oxidados y la energía perdida por los productos gaseosos de la digestión, sobre todo del metano en los rumiantes, obtenemos la energía metabolizable (EM). La energía metabolizable representa la suma de la energía de todos los productos asimilados una vez descontadas las pérdidas anteriores. Es un índice de gran valor pues a partir de ella, deducido la energía por el incremento del calor, se obtiene la energía neta (EN) del metabolismo. La energía neta responde a la energía usada directamente en las funciones celulares tanto la de mantenimiento (EN de mantenimiento) es decir la energía del metabolismo basal, actividad corporal, etc. Y la energía de producción (EN de producción) referida a la energía para crecimiento, trabajo, producción de leche, lana, reproducción, etc. Por supuesto todos estos conceptos tienen una utilidad práctica en los sistemas de alimentación sobre todo el concepto de energía digestible. A nivel metabólico como ya habíamos expresado se une el término de energía libre para ver la tendencia de las reacciones. Se refiere a la energía capaz de realizar trabajo biosintético, osmótico o mecánico y representada por las Kcal captadas en los enlaces macroenergéticos del ATP a partir de la oxidación de un mol de glucosa, de ácido graso o de aminoácido. Es decir son conceptos diferentes pues cuando hablamos de energía bruta o energía metabolizable se refiere a energía de combustión. Por ejemplo: 1 gramo de glucosa produce 3,76 Kcal de EB 1 gramo de ácido palmítico produce 9.35 Kcal de EB Mientras la energía química obtenida en forma de enlaces macroenergéticos del ATP es: 1 gramo de glucosa: 1.48 Kcal 1 gramo de ácido palmítico 3,58 Kcal Es decir hay una captación de un 39% para la glucosa de la energía total de estos compuestos y de un 38% para el ácido palmítico. Estos conceptos son muy útiles a la hora de entender el flujo energético en la naturaleza pues permite comprender que en el paso de los compuestos por todos los procesos metabólicos, por ejemplo de la glucosa al CO2 hay unas 21 reacciones, se va liberando energía en forma de calor e incrementando la entropía, en definitiva UNIDAD 2. METABOLISMO ANIMAL SOSTENIBLE Introducción En primer lugar, el metabolismo constituye una propiedad inherente de la vida. Todas las formas de vida, desde el microorganismo más simple, las plantas, los animales superiores, hasta el hombre, se manifiestan como sistemas altamente organizados, pero que necesitan obligatoriamente intercambiar constantemente sustancias y energías con el medio que los rodea o entorno. En este sentido, todas las formas vivientes deben considerarse como sistemas abiertos. Del medio toman los productos necesarios, los transforman haciéndolos asimilables, y con ellos forman sus propias estructuras al mismo tiempo que se destina, por otro lado, considerables cantidades de estos productos para la obtención de la energía requerida para todos los procesos vitales del organismo. Todo esto es el metabolismo el que está representado por el conjunto de reacciones que constantemente están sucediendo en cada organismo vivo en un momento determinado. Metabolismo es sinónimo de vida, donde hay vida hay metabolismo, cuando cesa la vida cesa el metabolismo.Por lo tanto , debe asegurar la asimilación de todos los productos necesarios para la célula. Esto al aparecer es simple, sin embargo, tiene su complejidad. Como es conocido los animales no pueden usar los productos tal como se presentan en los alimentos. Es decir, el animal tiene que transformar las proteínas, los carbohidratos, los lípidos, etc., presentes en la dieta, en productos que él pueda usarlos, es decir, en sus elementos constitutivos, tales como aminoácidos, monosacáridos, ácidos grasos, glicerol etc. Para ello el primer proceso metabólico a considerar es la hidrólisis y absorción de los alimentos ingeridos. Esto se hace posible por la existencia a lo largo del tubo digestivo de sistemas enzimáticos, pertenecientes a las hidrolasas, que hidrolizan las proteínas, las grasas, los carbohidratos, liberando sus elementos estructurales, los cuales son absorbidos. Para este segundo aspecto también el organismo animal dispone de sistemas especiales de transporte activo que aseguren el paso a la sangre y su posterior distribución a la célula de todos los elementos requeridos que van desde los aminoácidos, la glucosa y los ácidos grasos hasta el agua, las vitaminas, los minerales y otros factores más. No debemos olvidar que el metabolismo, a nivel celular, requiere del aporte constante de O2, por lo que existe un sistema encargado de su captación y su posterior traslado a las células. Con todo esto se cumple el primer objetivo. Pasemos ahora a una segunda fase, lo que algunos llaman metabolismo intermediario, por la forma escalonada y constituido por infinidad de pasos intermedios. El segundo objetivo del metabolismo está dado por la necesidad de la célula de disponer de fuentes de energía química para realizar todo el trabajo celular; es decir, asegurar la síntesis de ATP. En Líneas generales esto está formado por las diferentes vías catabólicas que van degradando las sustancias combustibles utilizadas para este fin. Cómo está organizado este aspecto. En primer lugar los principales compuestos combustibles tienen vías oxidativas particulares, que confluyen en una vía oxidativa común final. Estas vías catabólicas son: La desaminación oxidativa para los aminoácidos; la glucolisis para la glucosa y la beta oxidación para los ácidos grasos. Los productos finales de estas tres vías catabólicas confluyen en una vía común final conocida como ciclo de Krebs o ciclo tricarboxílico. Todas estas vías tienen como función principal apartar equivalentes de reducción, en forma de NADH o FADH a la cadena respiratoria para la síntesis de ATP. En estos aspectos no se debe ser absoluto, pues muchos de estos productos finales, son a su vez, punto de partida para la síntesis de innumerable cantidad de compuestos; sin embargo, la tendencia general de estas vías es oxidar los compuestos a CO2 y H20. De esta manera se asegura, por combustión química, la energía requerida para todos los procesos celulares. Pasemos ahora al siguiente objetivo conocido como trabajo biosintético, o sea, la formación de las sustancias y estructuras propias de cada animal en particular. En este proceso, que a grandes rasgos constituye el anabolismo, se forman todos los elementos requeridos para las células. En primer lugar está la biosíntesis proteica, mediante la cual se aseguran la disponibilidad de todas las proteínas necesarias para las funciones celulares. Este proceso, es, sin duda, el más importante dentro de todo el trabajo biosintético, dada las funciones de las proteínas y su participación en las estructuras celulares y de los tejidos. Para esto se utilizan grandes cantidades de ATP Al estudiar los procesos metabólicos podemos hacer ciertas abstracciones y estudiar casos particulares; por ejemplo: el metabolismo de la glucosa, el de la urea, etcétera. También podemos generalizar más estos conceptos y hablar del metabolismo de los glúcidos y metabolismo de las proteínas; igualmente podemos referirnos al metabolismo celular y al metabolismo hepático o renal; sin embargo, no debemos perder de vista que el metabolismo es uno solo y que todos los procesos metabólicos del animal están íntimamente relacionados y poseen estrecha dependencia. El metabolismo está constituido por dos fases: anabolismo y catabolismo, o fase anabólica y fase catabólica. Además, en algunos procesos metabólicos se puede considerar un estado intermedio o anabolismo. pueden darse generalmente dos tipos de RBE: reacciones de síntesis donde se pasa de sustancias simples a sustancias complejas; éstas constituyen el anabolismo y están caracterizadas por la síntesis y reacciones donde el proceso es a la inversa, o sea, reacciones de degradación donde las sustancias complejas se degradan en otras más simples, que constituyen el catabolismo. Ambas reacciones forman un todo y sólo podemos verlas aisladas en su estudio particular, pues para que existan las primeras (anabolismo) son necesarias las segundas (catabolismo). La vida se caracteriza por el constante intercambio de sustancia y energía con el medio. La materia que se encuentra formando parte de los organismos vivos presenta, sin duda, el más alto grado posible de organización. Este grado de organización requiere, como veremos más tarde, de cantidades apreciables de energía la cual es obtenida a partir de la degradación de las sustancias adquiridas del entorno. La organización de estructuras estables, la formación de compuestos bioquímicos, la síntesis de las hormonas, proteínas, lípidos, etcétera, todo lo cual constituye el anabolismo, requiere de cantidades apreciables de energía, la cual debe ser producida a partir de la degradación y posterior oxidación de parte de las sustancias asimiladas (catabolismo). Se comprende perfectamente que la cantidad de energía liberada en el catabolismo tiene que ser mayor que la consumida en el anabolismo para que el proceso, como un todo, transcurra en ese sentido. Por ejemplo, para sintetizar una molécula de proteína (reacción anabólica por excelencia) primero hay que oxidar otra sustancia que aporte la energía para ello (por ejemplo, la glucosa). La cantidad de energía producida en el segundo proceso (catabolismo) tiene que ser mayor que la consumida en el primero (anabolismo) para que el hecho se produzca, de aquí llegamos a la conclusión antes señalada. Quiere esto decir, que entre el anabolismo y el catabolismo se establece una unidad y una interdependencia total. La división entre el anabolismo y el catabolismo se hace con fines didácticos y haciendo abstracción de uno u otro proceso; sin embargo, esto no debe llevar a la idea de la existencia aislada de ambos procesos. El siguiente esquema, representa las características fundamentales del metabolismo animal. NUTRIENTES ENERGÉTICOS CARBOHIDRATOS GRASAS PROTEÌNAS PRODUCTOS FINALES ADP NAD+ FAD+ ATP NADH2 FADH2 BIOPOLÌMEROS MACROMOLECULARES CELULARES POLISACÀRIDOS LÌPIDOS PROTEÌNAS ÀCIDOS NUCLEÌCOS CO2 H2 O NH3 CATABOLISMO ENERGÌA QUÌMICA BIOMOLÈCULAS PRECURSORAS ANABOLISMO MONOSACÀRIDOS AMINOÀCIDOS ÀCIDOS GRASOS BASES NITROGENADAS Figura 4.Vías directas del metabolismo animal RBE y sostenibilidad El establecimiento de sistemas agropecuarios sostenibles, que permitan el desarrollo racional con un uso adecuado de los recursos naturales sin comprometer el futuro, preservando el medio ambiente y la biodiversidad, son temas de actualidad que preocupan a la comunidad científica del mundo entero. En los últimos decenios se han venido produciendo cambios en el equilibrio metabólico a nivel mundial entre los organismos autótrofos y los heterótrofos los cuales presagian, de seguir las tendencias actuales, serios problemas en la cadena alimentaria, los sistemas ecológicos, la biodiversidad y en definitiva en toda la biología y en el futuro de la humanidad. El crecimiento de las zonas urbanas, la contaminación de los mares, ríos y sistemas fluviales, (sobre todo por la afectacíón de las algas fotosintéticas) la deforestación de grandes zonas del planeta, los problemas de la erosión y la desertificación, la afectación de la capa de ozono, los residuos, el calentamiento de la atmósfera y otros grandes problemas de la actualidad, unido al incremento de la población mundial y al necesario incremento del número de animales, como fuente de alimentos para el hombre, con la utilización de grandes zonas de pastoreo y de producción de alimentos para los mismos, hace que este equilibrio se torne cada día más precario. Los organismos autótrofos (fotosintéticos) son responsables, mediante la utilización de la energía solar, de la fijación del CO2 con la formación de cadenas carbonadas (glúcidos, lípidos y aminoácidos) con alto nivel de organización y baja entropia requeridas por los organismo heterótrofos. Al mismo tiempo durante la fotosíntesis se libera el O, requerido para el metabolismo animal. Igualmente las necesidades de nitrógeno proteico de los animales se solucionan mediante la fijación del N, atmosférico, de los nitritos y nitratos realizadas por los microorganismos y los vegetales. A esto hay que agregar el exceso de utilización de los combustibles fósiles que durante millones de años ha acumulado la naturaleza con el consecuente aumento del CO2 Igualmente hay que considerar los problemas de la llamada "revolución verde" donde los incrementos de la producción vegetal y animal se han debido, en muchos casos. a un exceso de quimización de la agricultura y al uso, cada día más marcado de pesticidas, fungicidas, antibióticos, hormonas, etc., cuyos efectos residuales se van acumulando en los animales domésticos y sus productos y al final pasan al hombre, último eslabón de la cadenas alimentaria,por todo ello es necesario revalorizar todas las tecnologías que se utilizan hoy día para incrementar el metabolismo animal, sin que ello signifique abandonar el uso de la técnica y de las tecnologías más avanzadas, ajustándolas al concepto de sostenibilidad en el amplio sentido de lo que ello significa Capítulo 1. Metabolismo de carbohidratos en monogástricos y rumiantes Lección 1:Regulación del metabolismo Todos los procesos metabólicos en los animales domésticos están perfectamente regulados y controlados, lo que asegura el mantenimiento de las condiciones necesarias para el desarrollo adecuado de las funciones orgánicas. Los elementos a controlar y a regular en el organismo de un animal superior constituyen miles de sistemas y van desde el nivel de oxidación de una glucosa a síntesis de una proteína hasta la regulación del volumen acuoso, la concentración iónica, la presión sanguínea y muchos más. Todos estos sistemas tienen la responsabilidad de mantener, dentro de límites fisiológicos, la invariabilidad di medio interno manteniendo las condiciones constantes del mismo, o sea, la homeostasis celular. En el organismo animal los mecanismo de control y regulación de las actividades metabólicas pueden ser analizados desde diferentes planos. En primer lugar regulación hormonal y en el tercer lugar, la regulación nerviosa. La regulación bioquímica a nivel de cada célula está influenciada por múltiples factores y condicionada, en primer lugar, a las necesidades de energía y estructure para mantener el trabajo celular. A este nivel debemos considerar que la velocidad de una reacción bioquímica puede depender del pH, temperatura, concentración de sustratos y productos u otros elementos que ejercen su acción local en cada célula. Por otra parte, muchas enzimas se encuentran asociadas a nivel molecular, formando sistemas multienzimáticos, que catalizan vías metabólicas en su conjunto. Por ejemplo, la vía de la glucólisis, el ciclo de Krebs, o la cadena respiratoria, vías que incluyen 10 ó 12 reacciones, que requieren de otras tantas enzimas para su realización. A nivel celular existen también otros mecanismo moleculares representados por la activación o inactivación de las enzimas de determinada vía. A modo de ejemplo,citamos el caso de la degradación y la síntesis del glucógeno, según será analizado en el metabolismo de los glúcidos. Este mecanismo actúa por la incorporación de determinados radicales, grupos fosfatos, etcétera, en determinadas zonas del sitio activo de las enzimas activándolas o inactivándolas y con ella regulando el proceso metabólico que ellas catalizan. Por último, como mecanismo de regulación celular haremos referencia a la regulación alostérica. En los sistemas multienzimáticos se presentan enzimas que tienen el carácter de enzimas reguladoras, pues el estado de la misma determina la velocidad de reacción del sistema, son las llamadas enzimas claves o llaves de una determinada vía. Generalmente estas enzimas presentan carácter alostérico y muchas son multivalentes, es decir, pueden responder a dos o más metabolitos Lección 2:Anabolismo y catabolismo de carbohidratos. Incluye el metabolismo de los glúcidos varios aspectos de especial importancia para el organismo animal, entre otros: todo lo relacionado con el metabolismo del glucógeno, su síntesis (glucogenogénesis), su degradación (glucogenólisis), y la regulación hormonal y enzimática de este proceso. Además tenemos la glucólisis y asociada a ella, el ciclo de Krebs. Por último, gluconeogénesis y la vía oxidativa colateral de la glucosa. Todos estos aspectos serán estudiados, comenzando por la digestión y absorción de los glúcidos como paso previo para la entrada de la glucosa y otros glúcidos a la célula. Debemos también referir aquí algunas consideraciones sobre un proceso de especial significación en el campo de la biología, nos referimos a la fotosíntesis. La fotosíntesis es un proceso metabólico de primer orden en el caso de los vegetales y de gran repercusión para los animales y para la vida en general. Mediante la fotosíntesis, realizada por las plantas verdes, se fija en compuestos orgánicos la energía solar y el CO2 atmosférico liberándose al mismo tiempo 02 con lo que se establece un ciclo biológico entre animales y plantas que es la base de todos los procesos biológicos en nuestro planeta. Los compuestos orgánicos formados principalmente glúcidos que son usados como fuente de energía química por los animales o como sillares constitutivos de las cadenas carbonadas presentes en los aminoácidos, lípidos, vitaminas y demás compuestos orgánicos. La energía lumínica emitida por el sol es captada por las plantas, pues ellas poseen un pigmento muy similar a la hemoglobina, llamado clorofila, presente en los cloroplastos. La planta utiliza esta energía y la transforma en energía química. 2.1 Digestión y Absorción de los carbohidratos En la dieta normal de la mayoría de los animales y el hombre aparecen varios polisacáridos ,entre otros la celulosa, el almidón, el glucógeno, así como otros polímeros de la glucosa, hexosas, pentosas, etc. También algunos disacáridos (lactosa, sacarosa, maltosa y otros compuestos relacionados con los carbohidratos. Todos ellos son fuente de glucosa para las células, para ello, primero deben ser digeridos (hidrolizados) y después absorbidos.La digestión de los glúcidos se realiza a todo lo largo del tubo digestivo por medio de un grupo importante de enzimas hidrolíticas que en su conjunto reciben el nombre de carbohidrasas.En la boca, aunque con acción muy limitada por el poco tiempo que los alimentos permanecen en ella, actúa una amilasa, conocida como amilasa salival o ptialina capaz de hidrolizar los almidones hasta maltosa. Esta enzima que es activada por iones de cloruro, trabaja a un pH de 6,6 a 6,8 por lo que al llegar los alimentos al estómago se inactiva. En este lugar debemos considerar el efecto hidrolítico realizado por el ácido clorhídrico del jugo gástrico, el cual es capaz de hidrolizar un porcentaje considerable de los almidones y otros polisacáridos presentes en la dieta. Sin embargo, es en el intestino delgado donde ocurre la hidrólisis fundamental de los carbohidratos ingeridos, debido a la presencia de la amilasa pancreática, la cual es capaz de hidrolizar el almidón y otros polisacáridos de estructura semejante a la maltosa. La amilasa pancreática es una alfa-amilasa por lo que no actúa sobre las cadenas beta de los glúcidos, tales como la celulosa y otras estructuras. Su pH óptimo de acción es de 7,1, y actúa hidrolizando indistintamente los enlaces alfa 14 a lo largo de la cadena de amilasa de modo que produce finalmente una mezcla de glucosa y maltosa. La alfa amilasa puede actuar también sobre las cadenas de amilopectina, sin embargo, su acción se limita a los enlaces 1-4, no teniendo capacidad para actuar sobre las ramificaciones 1-6. Una enzima desramificadora (alfa 1-6), hidroliza los enlaces 1-6 en los puntos de ramificación liberando glucosa. Por la acción conjunta de estas amilasas se produce la hidrólisis del almidón. De esta manera se liberan en el intestino delgado grandes cantidades de glucosa y algunos disacáridos representados por la maltosa, así como otros tales como la sacarosa y la lactosa que pueden existir en dependencia de la dieta. Estos no pasan directamente a la sangre, sino que por acción de las enzimas específicas (maltosa, sacarasa, etc.), son desdoblados en el mismo epitelio intestinal, producto de la acción del jugo intestinal que poseen las mencionadas enzimas. Al final, producto de la digestión, se liberan a partir de los glúcidos ingeridos grandes cantidades de glucosa, galactosa, fructosa, pentosas y otros monosacáridos, los que deben ser absorbidos. Por otra parte, la celulosa, que constituye una fracción importante en la dieta de los herbívoros, no es modificada por enzimas propias del tubo digestivo, sino que a nivel del intestino grueso (colon y ciego) es degradada por acción bacteriana con producción de ácidos grasos inferiores, los cuales se absorben y son usados por el animal. Es de destacar el hecho de que parte de los carbohidratos ingeridos no se digieren y son eliminados con las heces, contibuyendo de forma destacada al normal funcionamiento del tubo digestivo. Los monosacáridos se absorben en el intestino delgado y pasan a la sangre por el sistema porta que los conduce al hígado. La absorción de estos puede realizarse por dos mecanismos: por difusión (pasiva) y por transporte activo. La posibilidad de la absorción pasiva (difusión) de algunos monosacáridos es, aunque no improbable, muy limitada y no fundamental. Es por ello que se debe considerar el mecanismo de transporte activo como el fundamental para la absorción de las hexosas y en especial para la glucosa. El paso de las hexosas a través de la barrera intestinal tienen lugar a una tasa fija e independientemente de su concentración en la luz del epitelio, así como en contra de un gradiente osmótico. Son también absorbidas más rápidamente las hexosas que las pentosas; todo ello hace concluir, que el transporte activo es el fundamental proceso de absorción de la glucosa. Es de destacar también que el transporte activo de la glucosa a nivel intestinal se puede bloquear por factores que inhiben el proceso de fosforilación y la síntesis de ATP, así como cuando disminuye el aporte de oxígeno todo lo hace concluir en un mecanimos activo con gasto de energía. 2.2 Glucogenogénesis Con el nombre de glucogenogénesis o glucogénesis se designa el proceso metabólico mediante el cual la glucosa es convertida en glucógeno, polímero de reserva de los glúcidos en las células animales. Mediante este mecanismo se almacenan grandes cantidades de glucosa cuando el aporte de la misma lo permite, utilizándose más tarde en dependencia de las necesidades del organismo. La glucogenogénesis es, la principal vía anabólica del metabolismo de los glúcidos.Prácticamente todas las células del organismo tienen la capacidad de almacenar la glucosa en forma de glucógeno, destacándose dentro de ellas las células hepáticas y las musculares. Las células del riñón, epitelio intestinal, del útero y otras más, presentan también niveles de glucógeno que deben ser tomados en consideración. Por el contrario, la neurona prácticamente contiene muy poco glucógeno, lo que determina la dependencia de las mismas del aporte directo de glucosa. El hígado, después de una comida rica en carbohidratos puede contener hasta el 1% de su masa de glucógeno. El sistema muscular, por su dimensión, es sin duda la mayor reserva de glucógeno del organismo. Cabe destacar, sin embargo, que las reservas de glucógeno del organismo en general son reservas para corto plazo. Es decir, utilizando sólo sus reservas de glucógeno un animal sólo tiene energía para unas 16 a 18 horas. Las reservas a largo plazo como veremos más adelante están representadas por los lípidos. La biosíntesis del glucógeno se realiza por un complejo enzimático, donde debe destacarse la acción de la glucógeno-sintetasa, enzima responsable de la incorporación de la forma activa de la glucosa a las cadenas preexistentes que forman el glucógeno. Es necesario precisar que el glucógeno no se forma de nuevo enteramente, sino que siempre existe una pequeña cantidad de glucógeno en la célula, lo que recibe el nombre de "semilla", el cual incrementa su volumen en dependencia del aporte de glucosa o decrece si es necesario, en caso contrario es necesario suministrar glucosa ala célula. Este último proceso recibe el nombre de glucogenólisis y será estudiado a continuación de este tema. Por ello debe considerarse siempre la presencia de cierta cantidad de glucógeno formando gránulos presentes en el citoplasma, que incluso presentan enzimas asociadas a ellos, que se encuentran en constante metabolismo según las condiciones celulares. La formación de glucógeno se realiza a expensas de la glucosa, sin embargo, todos los glúcidos pueden ser convertidos en glucosa en las células, por ello todos pueden, en la práctica, formar glucógeno. En el tema correspondiente a la vía colateral de oxidación de la glucosa veremos como las triosas, tetrosas y pentosas pueden ser convertidas en hexosas. Por otra parte, entre la fructosa y la glucosa existe un equilibrio regular catalizado por una isomerasa, al igual que entre la galactosa y la glucosa en este caso por una epimerasa. El glucógeno hepático constituye una buena reserva de glúcidos para las necesidades de las células del organismo en general. Es responsable, entre otras cosas, de mantener la glicemia normal que aporta la glucosa libre a todo el organismo, principalmente al tejido muscular que requiere constantemente de ella para formal sus propias reservas y, en especial, para mantener el aporte de glucosa ala neurona:, Por otra parte, niveles adecuados de glucógeno en el hígado hacen a este órgano más preparado para responder a los efectos tóxicos u otros productos nocivos. Es necesario señalar que en el hígado a expensas del glucógeno se forma el ácido glucorónico de gran importancia en los mecanismos normales de detoxicación hepática. Al mismo tiempo niveles inadecuados de glucógeno impedirían el uso de la glucosa por los tejidos con la consecuente movilización de las grasas, las cuales en su oxidación tienden a incrementar los niveles de cuerpos cetónicos. Por ello la existencia de adecuados niveles hepáticos de glucógeno son sinónimos de un buen funcionamiento del metabolismo en general. 2.3 Glucogenólisis Por glucogenólisis se entiende el proceso mediante el cual a partir del glucógeno se obtiene glucosa. Es por tanto la degradación del glucógeno a glucosa el cual ocurre como tal en el hígado pues en otros tejidos el producto final es la glucosa 6-fosfato que se incorpora a la vía de la glucólisis. La glucogenólisis pudiera considerarse el proceso inverso de la glucogenogénesis aunque los pasos no son los mismos a la inversa, Es necesario señalar aquí en este caso, de manera similar a la glucogenogénesis, el glucógeno no se transforma totalmente en glucosa, sino que, en dependencia de las necesidades de las células el mismo se degrada parcialmente quedando siempre un resto que, cuando el aporte de glucosa se restituye, es capaz de formar glucógeno otra vez. A nivel celular, tanto en el hígado como en el músculo, el metabolismo del glucógeno, que incluye su síntesis y su degradación tiene que estar perfectamente controlado. Se comprende, por ejemplo, que si una molécula de glucógeno estuviese por un momento sometida a la acción de la fosforilasa activa, estaría degradándose y si en otra, por el contrario, el efecto lo estuviese realizando la glucógeno sintetasa activa se estaría sintetizando. El efecto para la célula en cuestión sería en la práctica nulo. Por eso ambas enzimas están sometidas a un mismo control que depende a su vez de los niveles de AMP cíclico y de la acción hormonal y en muy estrecha relación con los mecanismos reguladores de la glucólisis y del ciclo de Krebs. Se comprende que un exceso de glucosa, abundante suministro de ácidos grasos, reflejado en niveles altos de ATP estimularía la acción de la glucógeno sintetasa e inactivaría la glucógeno fosforilasa con lo que se almacena glucógeno. Por el contrario, niveles bajos de glucosa por un intenso trabajo muscular u otra causa, con bajos niveles de ATP (con el consecuente aumento del AMP y el ADP) producirían un efecto estimulador sobre la fosforilasa e inhibirían la sintetasa. Analizando el proceso integralmente, el mecanismo de la regulación de la glucogenogénesis y la glucogenólisis depende en primer lugar de la activación e inactivación de las enzimas glucógeno sintetasa y la glucógeno fosforilasa, enzimas claves de ambos procesos por incorporación de ácido fosfórico a partir del ATP. La incorporación depende a su vez de dos quinasas o cinasas inespecíficas, las cuales podemos llamar glucógeno sintetasa quinasa y glucógeno fosforilasa quinasa y que llamaremos simplemente cinasa. La acción de esta cinasa es incorporar fósforo a la glucógeno sintetasa la cual se inactiva por este medio y a la glucógeno fosforilasa que por ello es activada, quiere decir que el efecto es contrario para ambas enzimas. Cuando cesa la acción de las cinasas se produce por la acción de las fosfatasas la eliminación del fósforo de la glucógeno sintetasa, con lo cual se activa y de la glucógeno fosforilasa inactivándola. 2.4 Glucólisis Glucólisis se entiende la degradación de la glucosa. La glucólisis como tal está constituida por una serie de reacciones mediante la cual la glucosa se convierte en ácido pirúvico. Este proceso, hasta aquí es universal y se desarrolla de forma similar en todos los organismos vivos, desde una bacteria hasta el hombre. La degradación de la glucosa hasta ácido pirúvico se conoce como la vía de EmbdenMeyerhof. A partir de este punto, ácido pirúvico, se produce en dependencia de las transformaciones que le ocurran a dicho ácido, diferentes modalidades que varían según los organismos y tejidos analizados y que par ello dan un carácter particular a cada glucólisis en cuestión y que en muchos casos señalan la obligación de aplicar un apellido a la glucólisis que se trate. En las células de los animales superiores el ácido pirúvico presenta dos destinos principales. El primero y más fundamental es su descarboxilación a acetil CoA con la incorporación de este compuesto al ciclo de Krebs o ciclo tricarboxilico donde es oxidado por completo a CO2. Esta glucólisis, que en verdad está formada por tres procesos bien identificados; vía de EmbdenMeyerhof, descarboxilación del pirúvico y ciclo de Krebs se acostumbra a llamar glucólisis aerobia y es clásica su reacción global.Esta secuencia se desarrolla, corno es lógico, en tejidos que tengan un aporte adecuado de oxígeno, pues requiere de la cadena respiratoria para aceptar los equivalentes de reducción que se producen. La segunda posibilidad del ácido pirúvico en los animales superiores es su reducción a ácido láctico la cual es típica en el tejido muscular en contracción, los eritrocitos y las células del cristalino del ojo. Esta reacción, la cual se desarrolla en un medio carente de oxígeno, es conocida como glucólisis anaerobia Otros organismos, sobre todo las bacterias, presentan distintas variantes en cuanto al metabolismo posterior del ácido pirúvico que caracteriza la forma propia de la utilización de la glucosa. Muchas levaduras, por ejemplo, convierten el ácido pirúvico en alcohol etílico, recibiendo este proceso el nombre genérico de fermentación alcohólica o fermentación etílica. Algunas bacterias producen ácido acético, láctico, propiónico, etcétera, por lo que el proceso recibe entonces el nombre de fermentación acética, fermentación láctica, propiónica.como se presenta en la siguiente figura. Figura 5 :Rutas metabólicas del ácido pirúvico 2.4.1 Vía de Embden-Meyerhof La vía de Embden-Meyerhof como tal está constituida por una serie de 10 reacciones, que se desarrollan en el citoplasma de la célula, al final de la cual la glucosa queda convertida en dos moléculas de ácido pirúvico. Para su estudio, dada la amplitud de la misma, es conveniente dividirla, de manera didáctica, dos etapas; una primera etapa que podemos llamar transformación de la glucosa en triosas mediante la cual la glucosa se prepara para su catabolismo transformándose en 3 fosfogliceraldehido y una segunda etapa donde se producen las reacciones de óxido-÷reducción y el 3 fosfogliceraldehído se convierte en ácido pirúvico y que llamaremos transformación de las triosas en ácido pirúvico. Pasemos a considerar la primera etapa de la glucólisis donde las hexosas (glucosa) quedan convertidas en triosas. Esta etapa de la glucólisis se inicia en verdad en la mayoría de las células a partir de esta etapa de la glucólisis se inicia en verdad en la mayoría de las células a partir de la glucosa 6 fosfato liberada en la glucogenólisis, sin embargo, para establecer un balance más adecuado la hemos iniciado a partir de la glucosa. En esta primera reacción la glucosa es fosforilada a glucosa 6 fosfato por acción de las hexoquinas que requiere la presencia de iones de Mg y el ATP como donador de radicales de fosfato macroenergético. Se puede considerar una reacción activadora que permite a la glucosa entrar en la secuencia de reacciones de la glucólisis. La hexoquinasa cataliza la reacción de fosforilación de la glucosa y de muchas más hexosas. Es una enzima reguladora pues puede ser inhibida por su propio producto de acción ya que cantidades apreciables de glucosa 6 fosfato en la célula inhibirían su activador alostérico de la glucógeno sintetasa (D). En el hígado la fosforilación de la glucosa puede realizarse por medio de la glucocinasa que no es inhibida por la glucosa 6 fosfato. Esta reacción e irreversible. En el siguiente paso la glucosa 6 fosfato es convertida en fructosa 6 fosfato por medio de la fosfohexosa isomerasa (fosfoglucoisomerasa). Es una reacción francamente reversible en ambas direcciones. Continúa la glucólisis con la fosforilación de la fructosa 6 fosfato a fructos 1-6 difosfato. Reacción catalizada por lo fosfofructo cinasa que requiere la colaboración de los iones de magnesio y el ATP como fuente de fosfatos macroenergéticos. Esta reacción es sumamente importante pues la fosfofructo cinasa es una enzima clave que regula toda la glucólisis por varios mecanismos. Esta enzima posee múltiples moduladores alostéricos positivos y negativos que son los responsables de regular su actividad que varían de una célula a otra. Concentraciones elevadas de ácido cítrico, ATP o de ácidos grasos de cadena larga la inhiben, mientras el ADP o el AMP la estimulan. Como es lógico suponer concentraciones elevadas de ATP crearían la posibilidad de su utilización por la célula de forma directa cuando sea necesario, por ello no haría falta seguir oxidando la glucosa. Por otra parte los excesos de glucosa, una vez cubiertos los niveles de glucógeno y de ATP, son convertidos en ácidos grasos a partir del acetil CoA o proveniente de la glucólisis. Para ello la vía de degradación de la glucosa debe ser mantenida, lo cual es realizado por un metabolito intermedio de esta vía, la fructosa 2-6 difosfato, que actúa estimulando la enzima fosfofructocinasa, independiente del nivel inhibitorio del ATP. Con ello la vía continúa hasta el acetil CoA que pasa a formar parte del Ciclo de Krebs. El siguiente esquema resume las vías anabólicas y catabólicas de la glucosa en los animales ,teniendo como eje central la glucosa-6-fosfato en la función celular hepática GLUCÓGENO 1 2 GLUCOSA -6FOSFATO HEPÀTICA TG ÀCIDOS GRASOS 3 5 GLUCOSA SANGUÌNEA NADPH Àcido pirùvico 7 COLESTEROL 4 RIBOSA-5FOSFATO NUCLEÒTIDOS 6 ACETIL-CoA ATP ADP+Pi 8 e- 9 CO2 O2 10 H2O Figura 6. Rutas metabólicas de la glucosa. Lección 3:Ciclo de Krebs En los animales superiores la única vía degradativa para el acetil CoA es su incorporación al ciclo de Krebs donde es oxidado totalmente a CO2. Este ciclo, de enorme significación dentro del metabolismo intermediario de los aminoácidos, glúcidos y lípidos, constituye de hecho la etapa final del metabolismo oxidativo de estos tres grupos de compuestos. Conocido inicialmente como ciclo del ácido cítrico y también como ciclo tricarboxílico, por las características de este ácido de poseer tres grupos carboxílicos, hoy se acostumbra a usar el nombre de ciclo de Krebs en homenaje al bioquímico alemán H. A. Krebs quien en 1937, a partir de una serie de experimentos realizados en suspensiones de músculos de paloma, integró y postuló la secuencia fundamental de la serie de reacciones cíclicas de esta vía metabólica, a la que él denominó ciclo del ácido cítrico , sentando las bases para un estudio más profundo sobre el tema. El ciclo de Krebs no es una vía metabólica particular de los glúcidos, sino que en sí constituye la vía oxidativa final común para los productos de la oxidación de los aminoácidos, los glúcidos y los ácidos grasos. Los glúcidos, lípidos y aminoácidos en sus vías catabólicas oxidativas, sufren primero una oxidación parcial en procesos metabólicos propios y los productos de esto pasan al ciclo de Krebs, donde son oxidados totalmente hasta CO2. Los aminoácidos originan por desaminación oxidativa determinados cetoácidos; la degradación de la glucosa por la glucólisis conduce a la producción del ácido pirúvico y acetil CoA, mientras que las grasas en su vía oxidativa,conocida como beta oxidación, producen también acetil CoA. Todos estos productos confluyen en el ciclo de Krebs, el cual es posible por la existencia de un juego completo de enzimas ubicadas en la fracción mitocondrial de las células del metabolismo aerobio, muy en relación con las enzimas de la cadena respiratoria, a la que aportan material reductor para la síntesis del ATP, lo cual es su principal objetivo. Por otra parte, aunque el ciclo como tal debe considerarse una vía catabólica, pues su función principal es la degradación del acetil CoA a CO2 , muchas de sus reacciones se encuentran en relación con otras vías del metabolismo. El ciclo, en su conjunto, se desarrolla en las mitocondrias de todas las células del metabolismo aerobio, que poseen las enzimas requeridas para catalizar las 10 reacciones principales de este ciclo, muy en relación con la cadena de respiración a la que aportan equivalentes de reducción (NADH) y (FADH) para la síntesis del ATP. El primer hecho importante de señalar la propia existencia del ciclo, donde al conjugarse los productos finales de los glúcidos, lípidos y aminoácidos, se produce un mayor aprovechamiento de los mismos. La existencia de vías distintas para cada uno de estos provocaría una mayor complejidad y menor eficiencia del organismo. Igualmente, es de mencionar la gran cantidad de energía que aporta el ciclo; el sistema del ciclo tricarboxílico es uno de los principales suministradores de material reducido a la cadena respiratoria para la síntesis del ATP. También, varios compuestos del ciclo se utilizan como material para la síntesis de nuevas sustancias. Por ejemplo, a partir de los ácidos axaloacéticos y cetoglutárico se originan por transaminación, los aminoácidos, el ácido aspártico y el ácido glutámico respectivamente, que están muy relacionados tonel ciclo de la úrea. Así mismo, para la síntesis del anillo porfirínico hace falta el succinil CoA. La utilización de los componentes del ciclo para estas reacciones permite sintetizar muchos productos de gran utilidad para el animal. De especial significación es la utilización del oxaloacético para la síntesis de la glucosa (gluconeogénesis), la cual se realiza a partir del ácido láctico, el ácido pirúvico y varios aminoácidos que deben originar como etapa intermedia ácido oxaloacético de forma que el componente central del ciclo se ve muy relacionado con la formación de glucosa en el organismo, por lo cual es posible señalar que todos los compuestos que originan oxaloacético pueden finalmente originar glucosa y glucógeno; por eso se designan con el nombre de glucogenéticos. Es de destacar tambiién la relaciión del ciclo con el nivel de cuerpos cetónicos. Producto de la oxidación de los ácidos grasos se producen residuos de ácido beta hidroxibutírico y beta cetobutírico. Estos compuestos tienen carácter cetónico y pueden oiginar acetona. Normalmente estos compuestos presentan un nivel fisiológico producto del equilibrio que mantienen con el acetil CoA que es oxidado en el ciclo, cuando el aporte de glúcidos es deficiente, no existen los niveles adecuados de oxaloacético para mantener el correcto funcionamiento del ciclo, por tanto, no se oxida el acetil CoA, lo cual provoca aumento en la sangre de los cuerpos cetónicos y se produce la cetosis. Tal es el caso que se produce en la cetosis bovina y en la diabetes mellitus, aunque por causa diferente.El esquema que se muestra a continuación,permite observar la integración del ciclo con las demás rutas metabólicas del animal. Figura 7. Integración de las vías metabólicas, a partir del consumo de forraje Lección 4. Fosforilación oxidativa La cadena respiratoria o sistema de transporte electrónico está constituída por una serie de reacciones enzimática de oxidación - reducción que se realizan a nivel de las mitocondrias de todas las células del metabolismo aerobio. La mitocondria ha sido llamada "planta motriz" ya que a este nivel es donde gran parte de la energía derivada de la oxidación es capturada en forma de un intermediario macroenergético, el ATP. La energía útil liberada en la oxidación de los glúcidos, los lípidos y los aminoácidos se produce en las mitocondrias. Para ello dispone de una serie de catalizadores, conocidos como cadena respiratoria, que intervienen en el transporte de electrones hasta su reacción final con el O2 para formar H2O; por tanto, la oxidación de los hidrógenos contenidos en las sustancias es el principal objetivo de la cadena respiratoria. Estas enzimas son las llamadas oxidorreductasas y fueron estudiadas dentro del capítulo de las enzimas; las principales son las deshidrogenasas con el NAD y el FAD de coenzimas y los citocromos, así como otras de carácter auxiliar. Además debe considerarse como componente de la cadena respiratoria la coenzima Q, con estructura semejante a la vitamina K, y a las ferro-sulfo enzimas, simbolizadas por Fe- S o por FeNH, debido al carácter del hierro no hemínico que poseen. Estos componentes de la cadena respiratoria están organizados según su potencial redox, los que van desde las deshidrogenasas ligadas al NAD, pasando por las flavoproteínas (FAD), a los citocromos y, finalmente, al oxígeno. Se encuentran acopladas unas a otras, pasando de las formas oxidadas a las reducidas y viceversa. 4.1 Organización de la cadena respiratoria La organización de los elementos que forman parte de una cadena respiratoria modelo o típica dentro de las mitocondrias ha sido objeto de múltiples estudios. El establecimiento de la secuencia de reacciones a partir de la captación del par de hidrógeno o equivalente de reducción de los sustratos por el NAD oxidado hasta el oxígeno a veces presenta serias dificultades. Actualmente se sabe que la cadena se inicia por las enzimas que trabajan con el NAD, el que se reduce a NADH que es la forma en que se recogen los electrones de muchos sustratos. Una flavoenzima FAD dependiente está situada bien a continuación o en un lugar destacado de la cadena encargada de oxidar el NAD reducido y reducir al sistema de los citocromos que se encuentran al final del proceso; sobre todo citocromo oxidasa que está en contacto con el O2. Muchos sustratos son deshidrogenados directamente por el sistema de las flavoenzimas FAD y FMN dependientes. Por otra parte en muchos sistemas transportadores de electrones de las mitocondrias de los animales y de otros organismos, se han encontrado, en la secuencia de las reacciones, a la coenzima Q y otras enzimas ferro-sulfuradas. La fosforilación oxidativa es el proceso mediante el cual la energía liberada por la oxidación del NADH en la cadena respiratoria es utilizada para la fosforilación del ADP a partir de la incorporación de un fósforo inorgánico con la consecuente formación del ATP y agua. Debemos recordar que en el ATP está presente la energía química requerida para todo el trabajo celular, ya sea osmótico, mecánico o biosintético. En este sentido el ATP constituye el núcleo central de todo el proceso de captación de energía y de todo el ciclo energético de la naturaleza. En relación con estos aspectos tiene vital significación el proceso de fosforilación oxidativa, por cuanto permite la captación de la energía liberada en la cadena respiratoria para la síntesis de ATP, que en esencia es la única forma posible de utilización de la energía por los animales para el trabajo celular. La teoría quimiosmótica formulada por Mitchel en 1968 supone que la energía liberada por el flujo de electrones en la cadena respiratoria es utilizada para la separación de los protones y los electrones de cada lado de la membrana interna de la mitocondria, explicando satisfactoriamente muchos aspectos hasta ahora no bien dilucidados. Según la misma, la membrana interna de la mitocondria posee un sistema de translocación selectiva de protones provenientes de la cadena respiratoria. Los protones son transferidos de la matriz mitocondrial al espacio externo de la membrana interna. La disminución de la concentración de H en la matriz mitocondrial se acompaña de un aumento en la alcalinidad (OH-) en el medio interno y un aumento de la acidez en el medio externo de dicha membrana. Lección 5. Regulación del metabolismo de los carbohidratos. Al analizar las diferentes reacciones, en particular de las distintas vías metabólicas de los glúcidos hemos referido, en cada caso que así ha sido necesario, los factores que intervienen en la regulación del proceso destacando, por un lado, la regulación alostérica y por el otro los mecanismos de activación e inactivación de las llamadas enzimas claves. Los mecanismos alostéricos son factores reguladores del propio sistema analizado, pues dependen de la concentración de los sustratos de las propias vías y en su conjunto constituyen factores que limitan o aceleran una vía determinada. Por otra parte los mecanismos de activación de las enzimas dependen de sistemas que se localizan en el exterior de las propias vías, generalmente dependientes del AMP cíclico y otros nucleótidos cíclicos (GMP cíclico) que a su vez depende del nivel hormonal. Varías son las hormonas que ejercen un efecto directo sobre los metabolismos de los glúcidos; entre otras citamos: los glucorticoides, la adrenalina, el glucagón, la STH, la TSG y la insulina. Los efectos particulares de estas hormonas sobre el metabolismo de los glúcidos serán analizados al estudiar el capítulo correspondiente al metabolismo hormonal, pues muchas de sus acciones tienen relación con otros productos, sobre todo los lípidos. Destaca por su importancia la regulación del nivel de la glucosa sanguínea (glicemia) el cual depende del aporte de glucosa a la sangre a partir de la glucogenólisis hepática y de la utilización de la glucosa por los tejidos extrahepáticos. El . mecanismo de control de la glicemia depende de un conjunto de factores y de la acción directa de varias hormonas. El glucagón, hormona hiperglicemiante del páncreas, es el responsable, en primer lugar, del mantenimiento de la glicemia, otras hormonas, tienen, por diferentes vías, algún efecto hiperglicemiante, entre ellas, la STH, los glucorticoides y la adrenalina. Por otro lado, la insulina presenta un marcado efecto hipogliceamiante al permitir la utilización de la glucosa por los tejidos. CAPÍTULO 2.Metabolismo de lípidos Lección 1:Introdución Los lípidos presentes en el tejido animal tienen su origen en las grasas ingeridas y en las sintetizadas en el organismo a partir de los carbohidratos o, en menor escala, de las proteínas. Estos lípidos están en constante intercambio, lo que constituye, en su conjunto, el metabolismo, que incluye como aspectos fundamentales: la digestión, absorción, circulación y depósito; la síntesis y degradación de los ácidos grasos; la síntesis y degradación de la glicerina; el metabolismo del colesterol y demás esteroles y, por último, su regulación. La hidrólisis de las grasas contenidas en los alimentos se produce fundamentalmente en el intestino delgado por medio de la lipasa pancreática, enzima producida por el páncreas exocrino que tienen la responsabilidad de hidrolizar los glicéridos en ácidos grasos y glicerina. La lipasa en una hidrolasa del grupo de las estereasas que presentan un pH óptimo de acción igual a 8. Su acción se ve favorecida por la función de los ácidos y sales biliares, que por su poder estimulante, es decir, por disminuir la tensión superficial, permiten aumentar considerablemente la superficie de contacto de la enzima con su sustrato. La acción de estos tres factores: pH, lipasa y bilis, permite la digestión de la mayoría de los glicéridos. El jugo pancreático posee también otra enzima, la colesterolestearasa , que hidroliza el colesterol esterificado a ácidos grasos, de forma que al terminar la digestión los productos serán ácidos grasos libres, glicerina y colesterol. A esto hay que añadir que no todos los triglicéridos son hidrolizados totalmente, pues la unión del ácido graso con la glicerina en la posición beta es hidrolizada muy lentamente, por lo que el monoglicérido es un producto importante de la digestión. Los alfa monoglicéridos pueden ser hidrolizados en la pared intestinal y los beta son resintetizados a triglicéridos. La absorción de las grasas ocurre a nivel de todo el intestino delgado,presenta cierta complejidad e implica la resíntesis de los triglicéridos a nivel del epitelio. Los productos de la digestión, ácidos grasos libres, glicerol, beta monoglicéridos y alfa monoglicéridos son utilizados para la síntesis de los glicéridos a este nivel, la grasa sintetizada pasa a los vasos linfáticos (quilíferos) y por el conducto linfático pasa a la sangre venosa, donde pueden describirse como partículas lipoproteicas, llamadas quilomicrones. El mecanismo de este proceso comienza con la unión de los ácidos grasos activados (acil CoA) con una beta monoglicérido, posteriormente se une otro acil CoA formando el triglicérido. También el glicerol libre puede ser absorbido pasando por la vena porta del hígado. Parte de los ácidos grasos libres, sobre todo los de pequeño peso molecular, pasan directamente al hígado por medio de la vena porta. Un pequeño número de ácidos grasos pasa a la circulación general esterifícados con los ácidos biliares en forma de complejos coleínicos. El alfa monoglicérido absorbido puede originar en la pared intestinal glicerol y glicerofosfato; este último puede combinarse con los ácidos grasos formando ácidos fosfáticos y finalmente triglicéridos. El colesterol se absorbe por los vasos linfáticos, principalmente como ésteres del colesterol y también como colesterol libre. Los fosfolípidos de la dieta son absorbidos como tales y transportados por la vena porta al hígado. La síntesis y la recirculación de los fosfolípidos aumentan en la pared intestinal durante la absorción de los lípidos, aunque su papel en dicha absorción no está bien definido. Los productos de la absorción de los lípidos pasan, ya sea por la vía linfática o venosa, a la circulación general, donde circulan unidos a las globulinas y de aquí son llevados a diferentes partes del organismo animal, que en forma general pueden señalarse como: a) tejidos de depósitos (tejido adiposo), b) tejidos en general y c) hígado Lección 2 Grasas en los tejidos Todos los tejidos del organismo animal necesitan de las grasas para su normal funcionamiento. La mayoría de las estructuras celulares y subcelulares son de constitución lipoproteíca. Tanto la membrana celular como el retículo endoplasmático, el aparato de Golgi y otros elementos celulares están formados o contienen lípidos en su estructura. Estos forman los lípidos de la circulación general a partir de ellos forman sus propias estructuras, la mayoría del tipo de las esfingomielinas, cerebrósidos y gangliósidos. También en estos tejidos pueden ser usadas las grasas como fuente de energía. El hígado, al igual que en el caso del metabolismo de los glúcidos y las proteínas, tiene una participación destacada en el metabolismo de las grasas. En él, ocurren varios procesos relacionados con estos compuestos, que veremos posteriormente, tales como síntesis y oxidación (beta oxidación) de los ácidos grasos, síntesis y degradación del glicerol, síntesis del colesterol, sales biliares y de la mayoría de los compuestos de los fosfolípidos y la síntesis de los triglicéridos. El hígado es también el lugar donde ocurre mayormente la liponeogénesis a partir de los carbohidratos. También se produce desaturación y saturación de ácidos grasos. La desaturación de los ácidos grasos en el hígado es un factor limitado a los de un solo doble enlace, por lo que los ácidos grasos de dos o más dobles enlaces no pueden ser formados en este órgano; así, el línoleico, linolénico y el araquidónico se deben considerar como ácidos grasos esenciales que deben estar presentes en la dieta. Las funciones de estos ácidos grasos esenciales parecen ser varias. Se encuentran en los lípidos estructurales de las células, en la membrana de las mitocondrias y en otros elementos celulares. A partir de ellos se forman las prostaglandinas.El hígado desempeña un papel clave en la cetogénesis. Una función hepática de gran importancia en relación con los lípidos es la formación de las lipoproteínas hepáticas. Las lipoproteínas del hígado, como su nombre lo indica, están formadas por dos fracciones; una proteica y otras lipídica que contiene una mezcla de triglicéridos, fosfolípidos y colesterol. Según esto pueden tener diferentes niveles y por ello diferentes índices de densidad clasificándose en: Lipoproteínas de muy baja densidad (VL DL) Lipoproteínas de baja densidad (LDL) y Lipoproteínas de alta densidad (HDL). Las lipoproteínas de muy baja densidad presentan mayor concentración en glicéridos, mientras las de baja densidad tienen mayor proporción de colesterol y las lipoproteínas de alta densidad incorporan una mayor proporción de fosfolípidos. El incremento de los niveles de las dos primeras puede traer trastornos al metabolismo de las grasas. Los ácidos grasos de los triglicéridos son incorporados a la lipoproteína de baja densidad y llevados al tejido adiposo. Estos ácidos grasos pueden tener su origen en la síntesis hepática a partir del acetil CoA proveniente de los glúcidos, por incorporación de AGI, desde la circulación o por la captación de los quilomicrones, de forma que cuando se alteran estos mecanismos, se puede producir acumulación de grasas en forma de triglicéridos en el hígado. Una extensa acumulación debe considerarse como patológica, lo que puede producir cambios fibróticos y hasta una cirrosis con el tiempo. El hígado graso puede producirse por dos motivos, en primer lugar por niveles elevados de AGL plasmáticos por una movilización exagerada, en este caso, el hígado forma triglicéridos, pero no tiene lipoproteína en cantidades suficientes para movilizarlos, por lo que estos se acumulan. Tal es el caso de dietas ricas en grasas, inanición, diabetes, cetosis, alimentación abundante en colesterina, biotina y tiamina, acción hormonal continuada, etc. El segundo tipo se debe a una deficiencia en la producción de las lipoproteínas bien por el bloqueo de la síntesis de la apoproteína, de la lipoproteína como tal, o como una falta en la provisión del colesterol o los fosfolípidos que se encuentran en la lipoproteína. Uno de los hígados grasos más estudiados se debe a esto último, o sea, por falta de factores necesarios para formar fosfolipidos de la lipoproteína, movilizadora de los glicéridos. Estos factores se conocen como factores lipotrópicos y están relacionados con la colina y los procesos de transmetilación de la metionina, a partir de donde se puede formar la colina necesaria para los fosfolípidos. De forma similar actúan otros elementos, que bien directa o indirectamente coadyuvan a la síntesis de la colina o a la salida del hígado, los que también deben considerarse como agentes lipotrópicos. Lección 3. Betaoxidación de ácidos grasos La oxidación de los ácidos fue señalada hace varios años por Knoop quien explicó los 1 mecanismos fUndamentales de este proceso, el cual recibe el nombre de beta de la cadena del ácido graso a partir del grupo carboxilo con liberación de acetil CoA. La beta oxidación es, por tanto, el mecanismo fundamental de oxidación de los ácidos grasos, que se lleva a cabo por varias enzimas presentes en las rrátocondrias, las cuales reciben el nombre de oxidasas de los ácidos grasos, íntimamente relacionadas con la cadena respiratoria. El proceso con la activación del ácido graso por una tiocinasa, enzima que actúa acoplada a la CoA y al ATP. Este es el único paso de la oxidación del ácido graso que requiere energía. Esta tiocinasa que en verdad es una sintetasa existe en las células bajo tres formas encargadas de activar los ácidos grasos de bajo, medio y alto peso molecular respectivamente. Esta reacción rinde los acil CoA correspondientes,posteriormente estos acil CoA son transportados al medio intramitocondrial por el sistema transportador de la carnitina, continuando el proceso dentro de las mitocondrias. El ácido graso activado o acil CoA es dehidrogenado por la Acil CoA deshidrogenasa, lo cual da como resultado un a - b desaturado CoA , que rápidamente capta agua, formándose el b - Bidroxiacil CoA, reacción catalizada por una crotonasa (enoil hidratasa). Posteriormente se deshidrogena por medio de la o. -hidroxiacil CoA deshidrogenasa, que depende del NAD para formar el β - cetoacil CoA (β- cetotiolasa) completamente por la presencia de la otra molécula de CoA, con liberación de una molécula de acetil de carbono menos que el inicial. Este último comienza nuevamente el proceso. Al terminar el proceso de la beta oxidación, se libera una molécula de acetil CoA y queda un ácido graso activado de dos carbonos menos que el inicial, que puede a su vez iniciar secuencia. Lección 4: Origen y degradación de los cuerpos cetónicos Muy estrechamente relacionados con la oxidación de los ácidos grasos se presenta un fenómeno conocido genéricamente con el nombre de cetosis. La cetosis se produce por incremento de los cuerpos cetónicos en la sangre, los cuales se originan en la oxidación de las grasas. Se conocen tres cuerpos cetónicos; el beta hidroxibutírico, el beta cetobutírico o acetoacético y el producto de la descarboxilación de éste, la acetona o propanona. Los dos primeros de estos compuestos son ácidos moderadamente fuertes y normalmente son amortiguados por los sistemas buffer de la sangre; sin embargo, cuando incrementan sus valores esto no es posible, por lo que se produce una acidosis, de forma que el proceso en su conjunto es una acidosis cetónica, con cetonemia y cetonuria. La cetosis como tal debe considerarse como un fallo del metabolismo; se presenta en la diabetes mellitus, la cetosis bovina y la toxemia del embarazo de las ovejas. Las causas de este trastorno pueden ser varias, según el tipo de cetosis, pero desde el punto de vista bioquímico el proceso es similar; empobrecimiento de los carbohidratos a nivel celular y exagerada movilización de las grasas, lo que provoca el incremento de los cuerpos cetónicos. El hígado es el principal órgano forrnador de cuerpos cetónicos (ceto0genético), en los rumiantes debe añadirse la glándula mamaria y la pared del rumen, mientras que los tejidos extrahepáticos utilizan estos cuerpos cetónicos para la obtención de energía, corno sustrato, por lo que son cetolíticos. El origen de los cuerpos cetónicos está en la oxidación de las grasas, y su cuantía, en el grado de esta oxidación, está en relación con una deficiencia en la utilización del acetil CoA, por incapacidad del ciclo tricarboxilico de catabolizarlo. También es evidente la relación que existe entre la producción de cuerpos cetónicos y la oxidación de las grasas por un lado y la degradación de los cuerpos cetónicos, la glucolisis y el ciclo de Krebs por otro lado, en relación muy directa entre el hígado y los tejidos extrahepáticos y el metabolismo de los glúcidos y los lípidos en general. Por otra parte, es indudable que en el rumiante se presentan características especiales que lo hacen muy susceptible al incremento del nivel de cuerpos cetónicos. Por un lado tenemos la producción de ácidos grasos volátiles ( AGV) del rumen, entre los cuales están el acético y el butírico, ambos con carácter cetogenético. Esto ligado a los bajos niveles de glucosa, que producto del propio proceso ruminal, normalmente presenta este animal, con el agravante, en las vacas lecheras de alta producción, de la gran cantidad de glucosa destinada a la producción de lactosa por la glándula mamaria. Esto hace que el rumiante destine gran parte de la glucosa producida por la vía de la gluconeogénesis a la producción láctea, pudiendo provocar en algunos casos estados de hipoglicemia, además de considerar los bajos niveles de la glucosa sanguínea en condiciones normales. La hipoglicemia provoca, por otro lado, un efecto estimulador sobre la liberación de la glucosa hepática, sin embargo, esta hormona provoca también liberación de ácidos grasos del tejido adiposo con el consecuente incremento de la oxidación de las grasas y de los cuerpos cetónicos. Todo ello provoca serios trastornos metabólicos en el rumiante que conducen a la cetosis. Lección 5.Anabolismo de ácidos grasos (AG) La síntesis de los ácidos grasos ocurre en varios tejidos del organismo animal; así el hígado, el riñón, el tejido adiposo y la glándula mamaria; entre otros, son capaces de sintetizarlos. El material necesario para ello es el acetil CoA aportado por medio de los carbohidratos. Se requiere también del aporte del NADPH2(reducido), el cual se origina por la vía de la derivación de la hexosa monofostato (ciclo de las pentosas) como elemento aportador de hidrógeno.Por otra parte ,se necesita un sistema extrarnitocondrial muy activo que está responsabilizado con la síntesis total de los ácidos grasos. En condiciones anaerobias, las mitocondrias producen la incorporación del acetil CoA a los ácidos grasos de moderado peso molecular. El sistema opera como semejanza a la reversión de la oxidación y requiere ATP, y CO2 y NADH, y NADPH2. Se señala también la necesidad del fosfato de piridoxal. El sistema extra mitocondrial es el que produce la síntesis de la mayor cantidad de ácidos grasos, sobre todo del palmítico y el esteárico, que son los predominantes en el tejido animal, requieren NADPH,, ATP Y CO, . La enzima clave de este proceso es la acetil CoA carboxilasa o malonil sintetasa, que requiere de la biotina como elemento aportador de CO2. La malonil CoA sintetasa es una enzima alostérica, que requiere del modulador positivo en este caso del ácido cítrico o del isocítrico. De esta manera se produce el malonil CoA que es la forma activa de incorporarse el acetil CoA a la síntesis de los ácidos graso. La síntesis de los ácidos grasos requiere una proteína portadora de grupos etilos (Acyl Carrier Protein, ACP) y de 6 enzimas, de ellas la enzima condensante (EC) dos tranferasas, dos reductasas y una hidratasa. La ACEP y la EC presentan restos de cisteina (-SH) en los centros activos que fijan los radicales acilos. En los animales superiores estas enzimas forman un complejo multienzimático que recibe el nombre de complejo ácido graso sintetasa. El proceso de la síntesis del ácido graso se inicia como señalamos con la formación del malonil CoA a partir de acetil CoA y la posterior condensación de este con el primer grupo de acetil, posterior condensación de este con el primer grupo de acetil, procedente también de acetil CoA , y que actúa como cebador de la enzima, quedando formado con beta ceto acil, en este caso el beta cetobutinil, que se mantiene unido a la ACP y el cual es reducido por las otras fracciones enzimáticas de la enzima ácido graso sintetasa. A continuación, tiene lugar el proceso reductor en el carbono beta con el aporte de NADPH2 ,bien directamente o bien por medio del FMM hasta producir el correspondiente acil saturado, en este primer paso el butiril, proceso este donde el cetobutiril y los productos siguientes se mantienen unidos formando un complejo multienzimático, el radical del butiril es transferido a continuación al grupo -SH de la enzima condensante (EC) quedando libre el - SH de la ACP, lo cual incorpora un resto de Matonil procedente del malonil CoA. Tiene entonces lugar la condensación del radical del butiril con el malonil, con pérdida del CO2 formándose el beta ceto caproil el cual repite el proceso reductor y así de nuevo hasta llegar al palmítico. El proceso ocurre en la parte extramítocondrial de la célula del hígado, pulmón, glándula mamaria y otros tejidos que requieren del aporte constante de acetil CoA y de energía. El acetato proviene fundamentalmente de los carbohidratos, que por esta vía aportan a la síntesis de los lípidos (lipogénesis) un material fundamental, no oxidado por la vía del ciclo tricarboxílico. Los ácidos grasos sintetizados se unen al glicerol, que puede ser aportado también por los glúcidos y en forma de triglicéridos son almacenados en el tejido adiposos y en otros tejidos en menor proporción. En la mitocondria, por otra parte, a partir del ácido palmítico tiene lugar el proceso de elongación con la producción de diferentes ácidos grasos de 18, 20, 22 y 24 átomos de carbono por la incorporación directa de acetil CoA. Este mecanismo es muy similar a la Beta - oxidación en sentido contrario y usa enzimas propias de este proceso metabólico,de igual manera ocurre en el retículo endoplasmático. CAPÍTULO 3.Otras vías metabólicas en los animales. Lección 1: Anabolismo y catabolismo de proteínas Uno de los aspectos más significativos dentro del metabolismo proteico, en particular, así como dentro del metabolismo en general, es la síntesis de proteínas. Por ello el estudio del metabolismo debe iniciarse a partir del dominio de los complejos mecanismos que posee la célula para asegurar la síntesis de sus propias proteínas. Recordemos que asociados a las proteínas están todas las estructuras que determinan las funciones de cada célula. No se debe considerar a las proteínas como únicas responsables de todas las propiedades que caracteriza a los organismos vivos, pues estas propiedades dependen de la interrelación de las proteínas, glúcidos, lípidos, ácidos nucleícos, vitaminas, minerales ; agua y otros factores pero, indudablemente que son las proteínas, la membrana celular, las diferentes estructuras celulares las que presentan en su composición proteínas específicas. La membrana celular, las diferentes estructuras celulares presentan en su composición proteínas específicas. La contracción muscular, el transporte activo, los procesos inmunitarios y otras funciones de las células tienen como base alguna proteína. Una simple bacteria, la E. coli, presenta más de 3000 proteínas diferentes. Por todo ello, se comprende que los mecanismos que posee la célula para asegurar la síntesis de sus propias proteínas revisten una importancia fundamental para todo el metabolismo en general. 1.1 Biosíntesis de proteínas Se considera la biosíntesis proteica como el mecanismo anabólico por excelencia, ya que permite la formación de nuevas células y tejidos, con lo cual se garantiza el crecimiento de la masa viviente. La biosíntesis proteica constituye un proceso endergónico que consume gran cantidad de energía en forma de ATP. Es un proceso universal que se realiza de manera similar en todas las especies, desde las más sencillas hasta el hombre, prueba palpable del origen común y que tiene como base una estrecha relación con los ácidos nucleícos, pues estos dan la información genética para la misma. Puede decirse sin exagerar que es un mecanismo perfecto en el cual los ácidos nucleícos conservan la información, la transcriben enviándola al citoplasma, donde se traduce en una proteína con una estructura primaria establecida según la información guardada en los ácidos nucleícos, lo que determina su función. De esta manera se establece una unión estrecha y funcional entre ácidos nucleicos, lo que determina su función. En la síntesis proteica participan del DNA y el RNA, éste por medio de los diferentes RNA ya conocidos, el RNArn, RNAt y el RNAr. El DNA, como se sabe hoy en día, contiene la información genética requerida para la síntesis de cada proteína específica. Esta información está presente en la estructura primaria del DNA, la cual es duplicada y transmitida a las células ihijasj por medio de la recopilación del DNA. La explicación del proceso de replicación del DNA no está dentro de los objetivos de este texto, pues corresponde más bien a la biología molecular. El mecanismo es sumamente complejo y requiere de varias enzimas. El DNA debe servir también para la formación de RNA, muy especialmente en la síntesis del RNA mensajero, proceso conocido como transcripción mediante el cual la información genética almacenada en el DNA requerida para proveer la estructura primaria (es decir, el orden de sucesión de los aminoácidos de proteínas específicas) puede ser transmitida al aparato sintetizador de la célula. Esto se realiza por la síntesis dentro del núcleo de la hélice , donde una tira de DNA sintetiza la tira complementaria de RNA; de manera tal que la T, C, G, y A del DNA incorporan en tiras sencillas de RNA a la A, G, C y U respectivamente. Esta reacción es catalizada por la enzima RNA polimerasa y las bases incorporadas están en forma de ácidos trifosforados. El orden de sucesión de las bases púnicas y pirimídicas en la tira de RNAm, determinada por la información trancrita por el DNA establece el orden de los aminoácidos, o sea, la estructura primaria de la proteína. La clave genética está constituida por un triplete de bases, ella debe dirigir la incorporación de un aminoácido cada tres bases. Como hay cuatro bases diferentes, las posibilidades de combinación posibles son sesenta y cuatro, de forma que puede haber más de una palabra o codón para cada aminoácido y otras no incorporan aminoácidos y se han llamado tripletes que terminan cadenas. Se ha demostrado que de los sesenta y cuatro tripletes posibles, tres no codifican aminoácidos. También se ha llegado a la conclusión que de las dos primeras bases del triplete son más específicas que la tercera. Además de los codones que terminan cadenas, parece que hay otros que inician cadenas, lo cual sugiere que las cadenas polipeptídicas comienzan siempre por el codón que codifica a la N-forilrnetionina . Por otra parte, el RNA ribosómico sirve de soporte para la realización de la síntesis. En los ribosomas de los animales superiores se han aislado cuatro RNA de diferentes velocidades de sedimentación. En general constituyen del 65 al 70 % del ribosoma. Además de otros ácidos, hay que señalar la participación en este proceso del RNA soluble o de transferencia ( RNAs o RNAt ). Este RNA realiza la transferencia de los aminoácidos desde el citoplasma a los sitios específicos del riboaosma durante la síntesis proteica. La unión del aminoácido activado con el RNAt es altamente específica por lo cual se requieren enzimas activadores para cada aminoácido que va a ser incorporado a la síntesis proteica, la unión del aminoácido activado con el RNAt es altamente específica por lo cual se requieren enzimas activadores para cada aminoácido que va a ser incorporado a la sínteis proteica. El RNA presenta una estructura similar a un treból, el extremo libre de unas de las cadenas presenta siempre ácido adenílico como nucleótido terminal, el cual fija el aminoácido activado. La molécula de RNAt posee una sección con tres bases libres, llamado anticodón, complementario del codón del RNAm. La molécula de RNAt puede tomar la forma de doble tira en ciertas unidades por medio de los enlaces de hidrógeno. También se ha considerado la posibilidad de una estructura terciaria en donde la molécula pueda doblarse para constituir una forma más globular. La síntesis proteica propiamente dicha, también llamada, desde el punto de vista genético, traducción, pues mediante ella se traduce la información genética contenida en el RNAm a la estructura proteica, se verifica en los ribo somas. Los ribosomas son partículas presentes en la fracción microsomal con diferentes coeficientes de sedimentación (s) en dependencia del organismo y el tipo de célula analizada. Los ribosomas de 50 s y 30 s contienen varios tipos de RNA y varios tipos de proteínas con actividad catalítica y son, al parecer, los predominantes en las células de los animales superiores. Pueden formar agregados activos de 70 s que constituyen el ribosoma funcional con la síntesis proteica. La síntesis proteica ha sido dividida para su estudio en cuatro etapas sucesivas llamadas activación, iniciación, prolongación y terminación respectivamente. 1.2 Regulación de la biosíntesis proteíca Las moléculas de RNAm no funcionan indefinidamente y la alteración o la destrucción de ellas puede suprimir la síntesis proteica. Esta proteína, que tendría una función en la célula, ya sea estructural o enzimática, no se formaría, por lo que no se realizaría esta función y el metabolismo celular se alteraría: por este medio el DNA (gen) regularía toda la función celular. Todo este proceso está a su vez regulado genéticamente mediante diferentes tipos de DNA y producto de las funciones de las proteínas sintetizadas (enzimas). El control de síntesis proteica está perfectamente regulado. La existencia de varios tipos de genes ha sido demostrada completamente. Así se ha señalado que el gen estructural DNA dirige la síntesis de enzimas específicas y otras proteínas por medio del molde RNAm. Hay además un gen operador (operón) que regula la acción de varios genes estructurales. Además, para un determinado sistema existe un gen regulador que actúa por medio de sustancia represoras. Los productos de la acción enzimática ejercen por retroalimentación, un efecto directo sobre el agente represor, que es, generalmente, una proteína y puede actuar alostéricamente determinando la represión de la síntesis proteica o la derrepresión (activación). A su vez, las enzimas sintetizadas modifican su velocidad de reacción por infinidad de factores. Numerosas hormonas ejercen acción directa sobre la síntesis proteica, bien estimulando la síntesis de RNAm o bien a nivel de ribosoma en el mecanismo de la traducción, estableciendo de esta forma un control directo sobre la misma. Cuando se produce un transtorno en este proceso, como por ejemplo alteraciones en el DNA, en el RNAm o ausencia del mismo, se deja de producir una enzima u otra proteína, o la misma que tiene una estructura primaria anormal lo que impide realizar su función. Este es el origen de varias enfermedades moleculares, como por ejemplo el caso de la llamada anemia de las células falciformes, donde el lugar ocupado por el ácido glutámico dentro de la molécula de hemoglobina es ocupado por la resina, el resultado es la formación de una hemoglobina anormal (hemoglobina S) y producto de ello, una anemia hemolítica. Por mecanismos similares se producen otros transtornos. Lección 2.Catabolismo de aminoácidos 2.1 Desaminación oxidativa La desaminación o la remoción del grupo alfa amino de los aminoácidos es el primer paso en su catabolismo. Se trata de una reacción catabólica irreversible que ocurre en el hígado, aunque el riñón también puede realizarla. La reacción es catalizada por la enzima aminoácido deshidrogenasa (o aminoácido oxidasa), la cual es flavina dependiente, o sea, que actúa acoplada al FAD. Tal parece que este proceso no le ocurre a todos los aminoácidos, sino especialmente al ácido glutámico mediante la enzima glutámico deshidrogenasa, que está bastante distribuida en todos los tejidos, así como en el hígado y el riñón. Según estos criterios, los aminoácidos originarían ácido glutámico por transaminación y este sera desaminado oxidativamente por la glutámico deshidrogenasa ,los productos finales de la desaminación son´: material reductor, un cetoácido y el NH3 . El material reductor puede ser bien en forma de NADH, o de FADH,„ según ocurre en uno u otro caso, su destino será la cadena respiratoria, que es oxidada por el oxígeno y aporta energía para la síntesis de ATP. El cetoácido generalmente es metabolizado por medio del ciclo tricarboxílico y por esta vía puede oxidarse totalmente a CO2 y H2O o convertirse en carbohidratos o grasas, siendo esta una fuente principal para la síntesis de glucógeno por la vía de gluconeogónesis. Si puede sintetizar carbohidratos, se clasifica como glucogenético ; si algunos de estos cetoácidos son convertidos en beta cetobutírico o acetil CoA pueden también originar cuerpos cetónicos y se clasifican como cetogenéticos. Este cetoácido también puede volver a convertirse en aminoácido por transaminación. El NH3 removido de los aminoácidos es eliminado del organismo en su mayor parte como urea. Este compuesto es, por tanto, el producto final del catabolismo proteico. Parte de este amoníaco puede ser excretado en forma de sal de amonio, sobre todo en los casos de acidosis. También por amidación del ácido glutámico (reacción catalizada por la glutamina sintetasa) puede ser fijado parte de ese amoniaco, sobre todo en el sistema nervioso central. Esto es esencial puesto que pequeñas cantidades de NH3 son muy tóxicas para el encéfalo, por lo que se utiliza ácido glutámico sintetizado a partir del cetoglutárico por transaminación para, la glutamina formada sería hidrolizada después en el riñón por la glutaminasa. 2.2 Transaminación El proceso de transaminación es catalizado por enzimas específicas, más conocidas como transaminas, se realiza entre un aminoácido que aporta el grupo amino y un cetoácido que acepta dicho grupo. El fosfato de piridoxal (Vitamina B6 ), actúa como coenzima. En esta reacción participan todos los aminoácidos a partir de sus respectivos cetoácidos. El alfa teto glutárico y el oxaloacético, cetoácidos del ácido glutámico y del ácido aspártico respectivamente, son los cetoácidos más comunes en estas reacciones. Por estos mecanismos los aminoácidos se interconvierten, con lo cual pueden ser sintetizados en los tejidos animales un aminoácido a partir de otro y el correspondiente cetoácido. Estos aminoácidos así formados, serán dispensables o no esenciales. Existen otros tipos de transaminación en los cuales la glutamina y la aspargina actúan como donadores del grupo amino. La transaminación tiene un papel esencial en la formación de la urea, en relación con la síntesis de los ácidos glutámicos y aspártico como medio de tranferencia de amoníaco para la producción de úrea. Las transaminasas también presentan un especial significado para el diagnóstico de las enfermedades del hígado, el corazón y los músculos. Estas poseen ciertos niveles séricos que se incrementan notablemente cuando hay afecciones en estos órganos. La elevación de la GPT es indicativa del daño celular en el hígado, mientras que el incremento de la GOT puede deberse a altraciones del corazón en los músculos o el hígado, todo lo cual tiene gran importancia para el diagnóstico, pues estos cambios comienzan aún antes de aparecer los síntomas clínicos. 2.3 Descarboxilación Se trata de una reacción que le puede ocurrir a todos los aminoácidos mediante la cual estos son convertidas en aminas con pérdida del grupo carboxílico,RCOOH, como CO2, la reacción es catalizada por la enzima aminoácido descarboxilasa con la vitamina B como coenzima, estas aminas biógenas pueden ser tóxícas (ptomaínas) y muchas son vasopresoras poderosas. La reacción puede ocurrir por acción bacteriana producto de la putrefacción, aunque también puede tener lugar en los tejidos normales y producida por enzimas propias Cuadro 2.Productos de descarboxilación de varios aminoácidos. Aminoácido Aminas biógenas Lisina Cadaverina Arginina Agmatina Tirosina Tiramina Ornitina Putrescina Histidina Histamina Serina Etanolamina Cisteína Beta mercapto Etilenamina Acido aspártico Acido glutámico Beta alanina Gama aminobutirico (GABA) Estas aminas son generalmente detoxicadas por el hígado por medio de un sistema enzimático, conocido como las mono amino oxidasa (MAO). Lección 3.Ciclo de la úrea El ciclo fue descrito por primera vez por H.A.Krebs y K.Henseleit en 1932 por lo que lleva sus nombres. La úrea( H2N-CO-NH2 ) ,constituye el principal producto del catabolismo de los aminoácidos; por tanto es un producto de desecho que se obtiene a partir de la oxidación de los aminoácidos. Cuando éstos son oxidados en el hígado, por medio de la desaminación oxidativa, se producen grandes cantidades de amoníaco (NH3), el cual debe ser eliminado del organismo ya que este producto es extremadamente tóxico, para ello el hígado lo convierte en úrea, lo que constituye un proceso de detoxicación del organismo.En la síntesis de la urea, que se realiza en el hígado, intervienen tres aminoácidos directamente, la ornitina , la citrulina y la arginina, que trabajan en forma de ciclo, y que tienen responsabilidades muy señaladas dentro del ciclo. Además, como aspecto muy importante hay que señalar que el proceso consume gran cantidad de energía; se gasta cuatro enlaces del ATP. Desde el punto de vista didáctico, el proceso puede ser separado en cuatro pasos : 1. Síntesis del carbamil fosfato. 2. Síntesis de la citrulina 3. Síntesis de la arginina 4. Hidrólisis de la arginina La síntesis del carbamil fosfato se realiza en la fracción mitocondrial por medio de la enzima carbamil fosfato sintetasa. El carbamil fosfato se forma a partir del NH5 libre producto de la desaminación oxidativa y el CO2.la reacción requiere de dos moléculas de ATP como fuente de energía, del acetil glutámico que actúa como activador alostérico de la enzima y de la biotina portadora del grupo CO2 . En general la reacción global de la formación de úrea sería: 2 NH3 + CO2 + 3 ATP + 3H20 Urea + 2 ADP + AMP + 4Pi Como puede observarse, el ciclo actúa como un pequeño proceso de producción, donde la "materia prima" es el amoníaco y el producto final, la urea. Asegurando este proceso por el aporte de energía en forma de ATP. Se discute mucho sobre el aporte de amoníaco al ciclo, la mayoría de los autores concuerdan en que esto se hace partir del ácido glutárnico y el aspártico o sea, los aminoácidos por trasaminación originarían ácido glutámico, que sería desaminado por la glutámico deshidrogenasa en el hígado, con lo cual aportaría NH3 al ciclo. El otro aporte de nitrógeno al ciclo es por el aspártico, el cual se resintetiza por transaminación a partir del oxaloacético. Una vez formada la úrea por el hígado, esta toma la circulación general difundiéndose a todo el organismo, dado su gran poder de difusión; de esta forma llega al riñón y se elimina con la orina. Lección 4 Metabolismo ruminal 4.1Introducción En general se puede decir que el metabolismo del rumiante transcurre por vías similares a las ya estudiadas, con las características propias impuestas por el trabajo bioquímico que tiene lugar en el rumen. Se acostumbra a hacer referencia siempre al rumen, aunque es sabido que los rumiantes presentan en su tubo digestivo un estómago pluricavitario que está formado por el rumen o panza, el bonete o retículo, el librillo u omaso y el cuajar, ahornas() o verdadero estómago. Los tres primeros (rumen, bonete y librillo) constituyen los llamados preestómagos de los rumiantes con las caracteristicas de no poseer glándulas en su mucosa e histológicamente presentan un epitelio escamoso estratificado, mientras el cuajar tiene todas las características del estómago normal de todas las especies. El rumen o panza ocupa la parte izquierda de la cavidad abdominal, desde el diafragma hasta la pelvis. Está formado por dos sacos, uno ventral y otro dorsal, con una capacidad promedio de 180 a 200 litros en animales adultos. Está desprovisto de glándulas e internamente la mucosa forma múltiples papilas que participan en la absorción de los productos de la transformación de los alimentos. El bonete está colocado contra el diafragma, en la parte antero superior del rumen, en comunicación con la panza y el librillo, su mucosa es también sin glándulas y toma la forma de panal de abejas por los repliegues que contiene. El librillo u omaso es algo globular, con mucosas pliegues o láminas recubiertas de papilas con el epitelio tonificado. El cuajar es como ya señalamos, el verdadero estómago del rumiante, con todas las características del estómago, donde ocurre la digestión. La existencia del rumen en los poligástricos permite realizar grandes transformaciones en los alimentos ingeridos, generalmente de bajo valor nutritivo, con la posterior utilización por eI rumiante de los productos de este trabajo bioquímico, los cuales son de mayor utilidad. Esto ha posibilitado la confección de dietas que sólo son posibles en estos animales. El metabolismo de los carbohidratos en el rumen es activo e importante. La dieta del rumiante contiene grandes cantidades de celulosa que, producto de este trabajo bioquimico ruminal, es utilizado en grado sumo. En dependencia del régimen alimentario del animal, pueden aparecer en la dieta mayor o menor cantidad de almidón si el animal está recibiendo concentrado. Otros glúcidos en la dieta pueden ser la hemicelulosa y la pectina. También debemos señalar que si el animal está sometido a dieta de miel, estará recibiendo grandes cantidades de glúcidos de pequeños peso molecular. La Figura 8 ,muestra la composición y origen de los nutrientes en los forrajes. MATERIAL VEGETAL Como el FORRAJE Tiene HUMEDAD Contiene MATERIA SECA (MS) Comprende Comprende MATERIA INORGÁNICA MATERIA ORGÁNICA Presente en CENIZAS (CZ) Contienen MINERALES(P,Ca, Mg,Si,Fe…) Contiene PROTEÍNA CRUDA (PC) Incluye NNP + NP Contiene EXTRACTO ETÉREO (E.E) Incluye GRASAS,AG, PIGMENTOS ÁCIDOSORGÁNICOS Contiene FIBRA CRUDA (FC) Incluye FDA +FDN+LDA Figura 8. Componentes químicos del forraje Las transformaciones de los carbohidratos en el rumen son intensas e implican dos procesos fundamentales; en primer lugar la hidrólisis de los polisacáridos, que pasando por polímeros de menor peso molecular y disacáridos, son llevados finalmente a monosacáridos, y en segundo lugar la fermentación de estos monoglúcidos con producción de ácidos grasos volátiles (AGV) fundamentalmente acético, propiónico y butírico. La hidrólisis de los polisacáridos es realizada por enzimas bacterianas del tipo de las hidrolasas pertenecientes al grupo de las carbohidrasas. La fermentación sigue pasos muy similares a las fases de la glucóli sis, ya estudiada, con producción primeramente de ácido pirúvico y a partir del cual se producen los AGV. En la Figura 9, se representa un esquema sobre las líneas generales del metabolismo de los glúcidos en el rumen. Producto del intenso trabajo bioquímico desarrollado en el rumen, principalmente a partir de las fuentes de carbohidratos , se producen también grandes cantidades de gases, encontrándose entre los principales el CO2 , el CH4 y el H2 . Estos gases son eliminados principalmente por el eructo, muy desarrollado en estos animales. Por otra parte hay que señalar que no todos los monosacáridos son fermentados en el rumen, pues parte se usan por los microorganismos formando polímeros, como el caso de los polisacáridos bacterianos, el glúcogeno de los protozoos, etcétera. Producto de la fisiología ruminal, junto con el bolo alimenticio, estos microorganismos pasan al cuajar y al intestino delgado donde son hidrolizados, de manera similar como ocurre en otros animales, constituyendo con ello una fuente de glucosa directa que es absorbida como tal. 4.2 Metabolismo de la Celulosa La celulosa es el principal poliglicérido presente en la dieta de los rumiantes. Está constituida básicamente por unidades de beta glucopiranosa unidas por enlaces glucosidicos 1-4, recubiertos en gran parte por lignina. La lignina no es un carbohidrato, sino un polímero de alcoholes aromáticos, que puede representar desde el 15 al 30 % de la masa seca. La estructura de la lignina no es conocida aunque se precisa que es una biopolímero estructural ,constituído por Benzaldehidos, polifenoles e isopropilbencenos, está presente en unidades repetidas. Figura 9.Bioquímica ruminal de forrajes La celulosa es el principal polisacárido estructural ingerido por los rumiantes, siendo notable la capacidad de los mismos para su utilización. Los rumiantes, entre ellos los bovinos y los ovinos, pueden utilizar la celulosa producto de la acción de los microorganismos del rumen, principalmente las bacterias tales como el Bacteroides succinogenes y el Ruminococus flavefaciens. Estas bacterias producen enzimas extracelulares que degradan la celulosa, así como la hemicelulosa. La enzima básica en la hidrólisis de la celulosa es una beta 1 - 4 glucosidasa (conocida como celulasa) que produce glucosa pasando por diferentes polímeros de masa molecular menores que la celulosa y finalmente por celobiosa, que es un diglúcido que se obtiene por la hidrólisis de la celulosa. La celulosa producida por la hidrólisis de la celulasa es fermentada, tambien por acción bacteriana, con la producción final de los ácidos grasos volátiles (AGV), acético, propiónico y butírico, otros ácidos en menor cuantía y diferentes gases . En la Figura 9, se muestra este proceso . 4.3 Metabolismo del Almidón y hemicelulosa El almidón es un polisacárido no estructural(CNE), constituido por unidades de alfa glucopiranosa con enlace gucósido 1-4 y ramificaciones 1-6. Generalmente junto al almidón se encuentran diferentes tipos de dextrinas y otros carbohidratos solubles. Cuando se administra mieles finales de la industria azucarera de los animales es considerable la presencia de sacarosa y otros oligosacáridos solubles en la dieta. Todos de manera general, presentan un metabolismo semejante. En condiciones normales de pastoreo el almidón no constituye un elemento básico en la dieta de los rumiantes, sin embargo, en la explotación ganadera moderna, con el suministro de concentrados a las vacas lecheras u otras categorías productivas, este polisacárido no estructural(CNE), ha pasado a constituir un producto en la dieta del rumiante. El almidón y otros carbohidratos solubles (CHOS), son degradados de forma semejante a la ya estudiada, primero son hidrolizado a monosacáridos y éstos se fermentan a AGV. En la figura 9, se presenta un esquema del metabolismo del almidón en el rumen. El AGV predominante a partir de la fermentación del almidón es el ácido propiónico, siendo considerable también la producción de láctico así como eI succínico y fórmico, en la cantidad de almidón en la dieta es significativa. Junto con la celulosa, que es el componente principal en la dieta de los rumiantes, se encuentra también otros productos en menor cuantía tales como la hemicelulosa. La pectina, fructuosa, xilanas, La hemicelulosa presenta, como base en su constitución difierentes tipos de pentosas, sobre todo xilosa y arabinosa, hexosas y ácido gluc urónico asociado a fracciones de celulosa de bajo peso molecular. Las pectinas presentan en su constitución el ácido galacturónico esterificado al metanol. En todos estos carbohidratos están presentes hexonas, ácidos urónicos, pentosas y otros componentes de menor significación. En su esquema metabólico en el rumen estos productos se metabolizan siguiendo patrones semejantes. Las hexosas se incorporan a la vía glucolítica, los ácidos urónicos se transforman en pentosas y estos juntos a las demás pentosas se metabolizan siguiendo la vía de la hexosa monofosfato o ciclo de las pentosas. En la Figura 9, se muestran estas vías. 4.4 Trastornos metabólicos ruminales: La cetosis. Despues de haber estudiado el metabolismo de los carbohidratos en el rumiante, se pueden comprender mejor ciertos trastornos metabólicos de estos animales, tales como la cetosis de la vaca lechera y la toxemia de la oveja gestante, caracterizados ambos por un fallo del metabolismo de los glúcidos con bajos niveles de glucosa sanguínea e incrementos de los cuerpos cetónicos. Según se desprende de los estudios anteriores el aporte de glucosa como tal, a partir de los carbohidratos ingeridos, es limitado en el rumiante productor de las fermentaciones que ocurren en el manen y que conllevan a la parcial transformación de los carbohidratos de la dieta en AGV. De estos tres AGV, uno es glucogenético ( el propiónico) y los otros dos son cetogenéticos (el acético y el butírico). Por otra parte, los niveles de la glucosa sanguínea de los rumiantes son normalmente los más bajos entre los animales superiores, encontrándose valores de 45 a 75 mg / 100 mL en los bovinos y de 50 a 80 mg / 100 mL en los ovinos, mientras en los equinos, porcinos y caninos, por ejemplo, pueden llegar hasta 100 o más mg / 100 Ml. Los niveles bajos de la glicemia de estos animales pueden estar en dependencia del pobre aporte de la glucosa como tal por la vía digestiva, la cual depende, en gran medida, de la hidrólisis de los polisacáridos bacterianos y de los protozoos. El déficit en el aporte de glucosa trata de ser compensado a partir de una mayor gluconeogénesis, proceso este, más desarrollado en el rumiante, tomando como producto gluconeogenético al ácido propiónico. En condiciones especiales, todo este complejo equilibrio de los rumiantes puede ser alterado, produciéndose un incremento en el metabolismo oxidativo de las grasas con el conveniente incremento de los cuerpos cetónicos y la presentación de las cetosis como tal. Esta alteración se produce, fundamentalmente, en la vaca lechera de alta producción producto de la gran cantidad de glucosa destinada a la producción de la lactosa, asociada a otros procesos de carácter metabólico hormonal y nutritivo que traen como consecuencia dicha alteración metabólica. Esto se manifiesta por hipoglicemia más o menos manifiesta y elevación del nivel de los cuerpos cetóncos. En estos casos se producen grandes alteraciones de las principales rutas metabólicas, pu por un lado la hipoglicemia provoca un efecto estimulados sobre la liberación del glucagón que a su vez estimula la liberación de la glucosa hepática por incremento de la glucogenogénesis, esto, como es lógico, da respuesta en dependencia de los niveles del glucógeno hepática Además, se debe considerar el efecto estimulante del glucagón sobre la liberación de los ácidos grasos del tejido adiposo, que de no existir reservas de glucosa en el hígado para su posterior redistribución traerá como resultado un exceso de la oxidación de dichos ácidos con el consecuente incremento de los cuerpos cetónicos, que requieren para su oxidación del funcionamiento adecuado de ácido oxaloacético, que por otra parte depende, en gran medida, del nivel de glucosa sanguínea y que también por la vía de la gluconeogénesis puede ser convertidos en glucosa y escapar hacia la formación de lactosa. En la Figura 14.9 hemos relacionado todos estos factores. Lección 5.Metabolismo de los compuestos nitrogenados ruminales. Incluye entre sus principales aspectos, el metabolismo de las proteínas, tanto la síntesis como la degradación o proteólisis; la síntesis y el catabolismo de los aminoácidos, así como los aspectos que comprenden el metabolismo del nitrógeno no proteico (NNP), en especial la urea como fuente de amoniaco y su posterior destino. El rumiante es capaz de usar diferentes fuentes de nitrógeno no proteico para satisfacer sus necesidades nutritivas, lo cual es posible por el trabajo bioquímico realizado por los microorganismos rumiantes, en especial las bacterianas. La dieta del rumiante contiene, como es lógico suponer, diferentes tipos de proteínas y compuestos nitrogenados en general de carácter no proteicos. Al mismo tiempo, producto de las características metabólicas especiales de estos rumiantes, al rumen llegan cantidades apreciables de urea procedente de la síntesis hepática, o en algunos casos, por la aplicación de la misma dieta. Todos estos productos son transformados en el rumen. Las proteínas hidrolizadas liberan aminoácidos, los aminoácidos son oxidados produciendo NH3 y cadenas carbonadas que conducen a la formación de AGV; el NH3 producto de la hidrólisis de la urea o de los aminoácidos pueden ser usados para la síntesis de nuevos aminoácidos y nuevas proteínas por las bacterias; estas a su vez son fuente de nitrógeno para los protozoos y por último todo pasa al cuajar donde ocurre la digestión final, adquiriendo el animal diferentes aminoácidos para cubrir los requerimientos de su propio metabolismo. Todo este trabajo representa un enorme beneficio para el rumiante pues le permite disponer de una fuente de compuestos proteicos en mayor cantidad y calidad que los recibidos inicialmente pudiendo satisfacer en gran medida su requerimiento nutritivo, desde el punto de vista proteico. 5.1 Metabolismo Proteíco en el Rumen Las proteínas sufren grandes transformaciones en el rumen. En este lugar puede ocurrir la hidrólisis (proteólisis) por enzimas bacterianas, así como la síntesis de nuevas proteínas a partir de los aminoácidos liberados o de nueva formación..La figura 10,muestra las vías metabólicas ,por medio de las cuales se degradan las proteínas en el rumen. Figura 10. Metabolismo proteíco ruminal Las enzimas proteoliticas del rumen son producidas por las bacterias y por los protozoos. Entre las bacterias con esta actividad se encuentran los géneros bacteroides Selenomonas y Butirivibrio, mientras los protozoos pertenecen a los géneros Entodinium y Endiplodium entre otros. Al parecer, la actividad proteolítica de las bacterias se encuentran localizadas en la superficie de las células bacterianas en contacto con el sustrato. Estas enzimas son responsables de hidrolizar las proteínas hasta aminoácidos, pasando por péptido de diferentes tamaños. Como es lógico el pH y el estado ruminal son factores que influyen de manera destacada en la actividad proteolitica general del numen. Por ejemplo, a pH 6-7 la actividad proteolítica presenta un estado óptimo. Las bacterias atacan preferentemente a las proteínas de la dieta, no así los protozoos que pueden actuar hidrolizando tanto las proteínas de la dieta como las proteínas bacterianas, a partir de las bacterias fagocitadas. Por esta vía, los protozoos en gran medida satisfacen sus necesidades de aminoácidos para formar sus propias proteínas. En relación con este aspecto debemos señalar, por último, que un porcentaje determinado de proteínas, sobre todo las de las paredes celulares recubiertas de lignina, escapan a la acción proteolitico del rumen y en muchos casos a la del cuajar e intestino, y aparecen en las heces fecales del rumiante. Esto está en muy estrecha relación con la solubilidad de las proteínas, pues es conocido que a medida que aumenta también la intensidad de la proteosis en este órgano. Por otra parte, en el rumen ocurre una intensa síntesis de nuevas proteínas. Tanto las bacterias como los demás microorganismo ruminales requieren para su metabolismo de su propia proteína, bien proteínas estructurales o proteínas enzimáticas. Como es lógico, las proteínas somáticas de cada microorganismo deben ser formadas a partir de los elementos básicos; o sea, los aminoácidos, los cuales pueden tener su origen en los aminoácidos procedentes de las proteinas ingeridas o a partir de los aminoácidos sintetizados por medio del nitrógeno amoniacal (N-NH3 ). La síntesis proteica a partir del NNP es, sin duda, uno de los aspectos más significativos en la bioquímica ruminal, pues permite la utilización de fuentes no proteicas en la alimentación de estos animales, economizando recursos alimentarios que son deficitarios en el mundo, como es el caso de las proteínas, y su posterior utilización para otros fines. Otro aspecto que queremos explicar, es la síntesis de proteínas por los protozoos, dada la mayor calidad biológica de estas proteínas que las proteínas vegetales ingeridas por el animal. Posteriormente el rumiante, producto del intenso metabolismo del rumen y el paso del contenido ruminal al cuajar e intestino, dispone de una fuente proteica de mucho más valor nutritivo que la ingerida inicialmente. 5.1.1 Metabolismo de los aminoácidos en el rumen Los aminoácidos también sufren de un intenso metabolismo en el rumen. En general, existe en el rumen, por un lado, la desaminación oxidativa de los aminoácidos con liberación de NH3 y la posterior conversión de la cadena carbonada en AGV; así como la síntesis de nuevos aminoácidos por aminación, con la correspondiente incorporación de NH3 a diferentes cetoácidos, los cuales pueden ser, inclusive, formados totalmente en el rumen. La desaminación de los aminoácidos en el rumen ocurre por la vía de la desaminación oxidativa dependiente del aminoácido oxidasa, acoplando al FAD. La cantidad de aminoácidos libres normalmente es baja, ya que la mayoria son convertidos en NH3 , AGV y CO2, solo unos pocos son incorporados como tal a las proteínas celulares. La desaminación de los aminoácidos libera NH3 que debemos considerar dentro del total de NH3 del contenido ruminal. Producto de la desaminación de los aminoácidos en el rumen se producen AGV de cadenas ramificadas, tal como el isobutírico y el isovalérico. Muchos aminoácidos en el rumen también, producen compuestos aminados o aminas biógenas que más tarde son metabolizadas liberando NH3 y AGV. En definitiva, todos los aminoácidos del rumen pueden ser convertidos en estos productos. Por otra parte es conocido que las bacterias ruminales son capaces de formar el esqueleto carbonado de muchos aminoácidos, entre otros: lucina, valina, isoleucina, fenilalanina, glutámico, triptófano, alamina etcétera. Entre ellos, muchos considerados esenciales en otras especies de animales. Esto nos obliga a considerar el concepto tradicional de aminoácido esencial bajo otro ángulo para esta especie. Diferentes autores consultados coinciden en este aspecto, aunque faltan estudios más profundos para considerar la relación de aminoácidos esenciales en los rumiantes algunos señalan a la lisina y la metionína como limitante, aunque ambos también se sintetizan en el rumen. La figura 11,muestra un resumen de estos procesos descritos en el rumen. Figura 11. Metabolismo de aminoácidos en el rumen. Muchas bacterias del rumen son capaces de fijar el NH3 al cetoglutárico por medio de la glutámico deshidrogenasa, que puede trabajar acoplada al NADH2 O NADPH2 como elemento reductor. Por este mecanismo se sintetiza el ácido glutámico, el cual, con los correspondientes cetoácidos, puede originar diferentes aminoácidos por transaminación. El cetoglutárico se obtiene por la vía del ciclo de Krebs.. Con esto se asegura la síntesis del glutámico requerido para la formación de la arginina y prolina, aminoácidos pertenecientes a la familia del ácido glutámico. Muchas bacterias incorporan el NH3 al glutámico por la vía de la glutamina sintetasa. La glutamina formada puede incorporar el NH3 a la síntesis de otros aminoácidos o las bases púricas. BIBLIOGRAFÍA • Solomons, G, Química Orgánica, 1999, Limusa, México • Bohinski R, Bioquímica, 1998, Pearson, México D.F 739p. • Stryer Lubert, Bioquímica,1995, Reverté, Barcelona, 835 • CURTIS HELENA; Biología, Editorial Médica Panamericana, 2001. • Lehninger Albert. 1983. Bioquímica. Barcelona. Ed. Omega. • Conn E, Stumpf. 1970. Bioquímica fundamental. 2ª ed. México. Ed. Limusa-wiley. • Lehninger Albert. L. 1975. Bioenergética. F.E.I. USA. • Jiménez Vargas, Macarulla J, 1986. Fisicoquímica fisiológica. 6ª edición. Interamericana – McGraw – Hill. España. • Mohar H. Filiberto.2000. Bioquímica y Metabolismo animal. UNAD. Facultad de Ciencias Agrarias Bogotá D.C. • Stryer Lubert. 1976. Bioquímica, Ed. Reverté S.A. España. • Fessenden R. Y Fessenden J. 1983 Química orgánica. Grupo editorial iberoamericano. México D.F. • Garzón G. Guillermo. 1990. Química general con manual de laboratorio. Mc. Graw hill. Bogotá D.C. • Granados J. y García J. 1999. Fisicoquímica aplicada. Editorial Antropos, UNAD. Bogotá D.C. • General chemistry collection 4. 2000 JCE software. USA. Sitios WEB: http://bioquimicasite.googlepages.com/ http://phpwebquest.org/wq25/webquest/soporte_mondrian_w.php?id_actividad= 56015&id_pagina=1 http://biochemjairo.blogspot.com/ http://quimica1genral1.googlepages.com/ http://phpwebquest.org/wq25/webquest/soporte_mondrian_w.php?id_actividad= 55022&id_pagina=1 http://quimica1general1.blogspot.com/ http://faculty.clintoncc.suny.edu/faculty/Michael.Gregory/files/Bio%20101/Bio%2 0101%20Lectures/Biochemistry/biochemi.htm http://www2.nl.edu/jste/lipids.htm http://telstar.ote.cmu.edu/biology/downloads/membranes/ http://www.wiley.com/legacy/college/boyer/0470003790/animations/cholesterol/ cholesterol.htm http://www1.br.cc.va.us/murray/Serendipity/Biology/lecture/ch3_chemistry_of_or ganic_molecules.htm http://www.sumanasinc.com/webcontent/anisamples/nonmajorsbiology/proteinst ructure.html http://gslc.genetics.utah.edu/units/basics/tour/ http://www.stolaf.edu/people/giannini/flashanimat/proteins/protein%20structure. swf http://www.biocab.org/Biology.html#anchor_13156 http://www.biochem4schools.org/default.htm