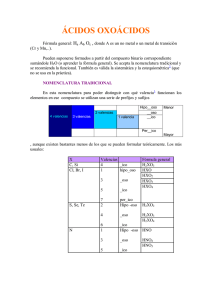
Practica Examen Parcial III Trimestre, I Parcial
Anuncio

Practica Examen Parcial I. Parte: Lewis structures Write in electron dot diagram the following elements: A) B) C) D) E) F) G) H) Lithium Calcium Barium Rubidium Boron Carbon Oxygen Nitrogen II. Parte: Nomenclatura A) La formula química expresa ___________________de los átomos y las moléculas B) Exprese la formula química de los siguientes compuestos: 1. Na+ y Cl- : 2. Mg+2 y N-3 : 3. Ca+2 y P-3 : 4. Al+3 y ClO4-3: C) Los Números de Oxidación indican la cantidad de ____________utilizados al_______________. D) Cuando un átomo pierde o comparte electrones, este adquiere una carga_________ y cuando los gana, adquiere una carga________ E) El Conjunto de reglas para nombrar compuestos es conocido como_____________ F) Cuando un elemento se encuentra a la izquierda de un compuesto, es él_______ y el que se encuentra a la derecha es el _________ G) El tipo de nomenclatura que utiliza números romanos para indicar el numero de oxidación del elemento positivo es ______________ H) Utilizado únicamente en Hidrácidos______________ I) Utilizado para compuestos que incluyan no-metales.________________ J) Los tipos de compuestos de acuerdo a la cantidad de elementos que tienen son: 2___________ 3____________ 4___________ K) Para nombrar compuestos, se leen de ___________ a ____________ L) En nomenclatura, el oxigeno recibe el nombre de __________ y el hidrogeno de _______ M) Los compuestos que están formados por un metal y un no-metal reciben el nombre de_______________ N) Los óxidos metálicos están conformados por _________ y un _________ O) La sal de no metal contiene dos ____________ P) Los hidruros metálicos utilizan_______________ Q) Los óxidos no-metálicos están formados por_____________ R) Los hidróxidos utilizan_______________ S) De el nombre de los siguientes compuestos: 1. SnO 2. HgO 3. ZnH3 4. LiH 5. Na2O 6. V2O3 7. FeO 8. Li2O 9. Co2 10. Cl2O7 11. CuF2 12. ClSn 13. CuF 14. PtBr2 15. CaF2 16. PbBr4 17. NCl3 18. SF4 19. IBr2 20. CF4 T) De las expresiones de nomenclatura, complete la tabla Acido Nítrico Amoniaco Metano PH3 H2O Cianuro U) De las siguientes tablas de números de oxidación complete: ( los espacios que contengan más de un numero/símbolo/elemento es por que comparten el numero) ( Cuando más de un elemento tenga el mismo número de oxidación, se pone en la misma casilla) V K, Ag F Al Manganeso Potasio, Plata Molibdeno Aluminio Cromo S Pt Br Bromo +2, +3+4+5 +2+3+4+5+6 +2+3+4+7 -1 +2+3+4+6 -2+4+6 + -1+1+5 +4 Plomo/Estaño Hierro, Níquel, Cobalto Cl, I N, Ar Carbono Nitrógeno, Arsénico Oxigeno -3, +3, +5 Ca,Zn +1+2 Au III. Reacciones y Ecuaciones Químicas A) Una reacción química es_________________________ B) Cuáles son los cinco signos que indican que está ocurriendo una reacción química_____________________________________________________________ ________________ C) Como se lee la siguiente ecuación : A + B C ______________________________________________________ D) Escriba la ley de la conservación de la masa:_________________________________________________ E) Escriba nuevamente la ley de la conservación de la masa_______________________________ F) Se tiene que balancear una ecuación cuando________________________________ G) Balancee las siguientes ecuaciones: 1) Fe + O2 FeO 2) H2 + O2 H2O 3) Na + H2O NaOH+ H2 4) C3 + H8 CO2+ H2O H) Una ecuación se balancea por medio de ______________ I) Complete la siguiente tabla con la clasificación de las reacciones químicas: Tipo Proceso C se descompone en A y B Formula Doble Desplazamiento A desplaza a B al reaccionar A+BC J) Determine a cual tipo de reacción es cada ecuación. 1) AgNO3 + Na Cl → NaNO3 + AgCl __________________________________ 2) 3Mg + 2FeCl3 → 3MgCl2 + 2Fe__________________________________ 3) 2Mg + O2 → 2MgO_______________________________ 4) 2CuH → 2Cu + H2_________________________________ 5) PCl3 + Cl2 → PCl5________________________________ K) Como podemos saber, en una reacción, cuando se libera o se absorbe energía? Comparando_________________ y __________________ L) En la reacción exotérmica la energía es________________ por medio de_____________ M) En la reacción endotérmica, la energía es________________ y se almacena en los____________ N) La velocidad mediante la cual se forma un compuesto es conocida como___________________ O) La energía de activación es____________________ P) Algunas fuentes de energía para las reacciones químicas son (3)_____________________ Q) Complete la tabla con los factores que afectan la tasa de reacción: Factor ¿Cómo afecta? Al incrementar la temperatura, los átomos se mueven mas rápidos y hay mas colisiones Inhibidores Concentración Sustancias que aceleran la reacción química, como las enzimas. Cuando incrementa, incrementa la tasa de reacción. Entre más espacio haya donde pueda ocurrir una reacción. R) Cuál es la importancia de las reacciones en la vida diaria:______________________________________________________________ ___________________________________________________________________ ___________________________________________________________________ ________