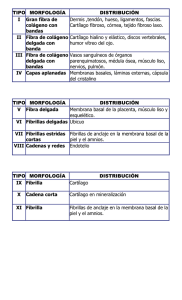
1ER TEMA CARTILAGO ARTICULAR Esta formado por células (condrocitos), agua y una matriz extracelular (MEC) que le confiere La forma y las propiedades mecánicas. Los condrocitos de distintas zonas del cartílago difieren en tamaño; forma y actividad metabólica, con frecuencia contienen filamentos intracitoplasmaticos, así como cilios cortos que se extienden al interior de la matriz y perciben los cambios mecánicos del entorno. Los condrocitos obtienen su nutrición del líquido sinovial a través de una doble barrera de difusión. La MEC esta formada por agua (65 a 80 % de su peso húmedo), proteoglicanos y colágeno, predominantemente del tipo II (95%) y otros (IV, VI, IX, X, XI). Los tipos IX y XI estabilizan la fibrilla de colágeno tipo II ensambladas. El tipo VI puede formar parte importante de la matriz que rodea al condrocito. La molécula de proteoglicano aglicano contiene muchas cadenas de glucosaminoglicanos (keratan sulfato y condroitín sulfato), estos agréganos se organizan en el interior de la estructura del colágeno produciendo una matriz sólida de colágeno-proteoglicano cohesionada y fuerte. Los proteoglicanos (de carga negativa) son los responsables del contenido hídrico del cartílago. El cartílago articular esta dispuesto en capas de distinta morfología y composición bioquímica, con propiedades mecánicas que varían dependiendo de la distancia entre la capa y la superficie articular. De la zona superficial a la profunda, las tensiones tangenciales aumentan, mientras que la rigidez tensil disminuye. Los condrocitos de la zona superficial (tangencial) sintetizan mayor cantidad de colágeno y menos proteoglicanos, y la disposición paralela de las fibrillas de colágeno le da mayor rigidez tensil y mayor resistencia que las zonas más profundas. La zona media (de transición) es la parte mas grande del cartílago articular (40 a 60%) y su composición morfológica y de matriz es intermedia entre la zona superficial y la profunda. La zona profunda (radial) tiene fibrillas de colágeno de mayor diámetro, máxima concentración de proteoglicanos y menos cantidad de agua, las fibrillas de colágeno llegan a la marca de ondas, que es la frontera entre cartílago calcificado y no calcificado y donde las fuerzas tangenciales son máximas. Una zona de cartílago calcificado separa la zona radial del hueso subcondral, sus células son muy pequeñas y están rodeadas de cartílago calcificado. El cartílago articular presenta un comportamiento que depende del tiempo cuando es sometido a carga o deformación constante, es decir, su deformación aumenta con el tiempo hasta alcanzar un equilibrio. De forma análoga cuando el tejido se deforma y se mantiene con una distensión constante, la fuerza aumenta hasta un máximo, seguido de un proceso lento de relajación de la fuerza hasta alcanzar un valor de equilibrio. La viscoelasticidad depende de 2 mecanismos: al caminar o correr, el cartílago se somete a fuerzas que elevan varias veces el peso corporal en un periodo muy corto de tiempo. En este entorno de carga dinámica el líquido intersticial del interior de la matriz permite existir estas fuerzas compresivas elevadas sin sufrir lesiones. Cuando el líquido intersticial fluye a través de la matriz, se crea una interacción de roce entre el líquido y la matriz que proporciona un mecanismo para la disipación de la energía. Este fenómeno se denomina viscoelasticidad bifásica dependiente del flujo. El segundo fenómeno o mecanismo se denomina viscoelasticidad intrínseca independiente del flujo y esta dado por las características viscoelásticas propias de los proteoglicanos y las fibras de colágeno, este mecanismo gobierna el comportamiento a corto plazo del cartílago articular inmediatamente después de la aplicación de una carga. La inmovilización de una articulación causara una rápida perdida de proteoglicanos de la matriz del cartílago, aumentando el flujo de líquidos y la deformación en respuesta a la compresión. Las propiedades tensiles dependientes del colágeno se mantienen. El grado de recuperación disminuye a medida que aumenta el periodo de inmovilización. La alteración de las estructuras intrarticulares como meniscos o ligamentos modificara la fuerza que actúa sobre la superficie articular. Se han observado reducciones importantes y progresivas del momento tensil y tangencial en respuesta a la sección del ligamento cruzado anterior. Los factores de crecimiento como el factor de crecimiento de tipo insulinico I y el factor de crecimiento transformador ß (TGF-ß) pueden estimular la síntesis de matriz y la proliferación celular. El catabolismo de la matriz se produce a través de enzimas, como la estromelisina, la agrecasana y la colagenasa reguladas por factores locales como la IL1, prostaglandinas, el TGF-ß, el factor de necrosis tumoral y otras moléculas. Las lesiones mecánicas del cartílago articular pueden ser de tres tipos: 1) lesión microscópica de los condrocitos y la MEC 2) alteración macroscópica del cartílago articular (fractura condral) 3) fractura osteocondral La lesión microscópica puede deberse a un solo evento traumático o a múltiples cargas repetitivas. Estos mecanismos causan una lesión de los condrocitos y afecte su capacidad de producción de colágeno y proteoglicanos. Tras una lesión del ligamento cruzado anterior, la lesión osteocondral oculta puede detectarse hasta en 80% de los pacientes mediante resonancia magnética. La localización mas frecuente de estas lesiones en el compartimiento lateral de la rodilla, en el cóndilo femoral externo en el surco terminal y la meseta tibial posteroexterna. Las fracturas condrales son problemáticas debido a su limitada irrigación haciendo que las posibilidades de cicatrización sean limitadas. Las lesiones osteocondrales causan hemorragia y formación de coágulos activando la cascada de inflamación, los productos hemáticos del coagulo de fibrina liberan mediadores vasoactivos, factores de crecimiento y citocinas estimulando la invasión vascular y la migración de células indiferenciadas, lo cual puede desempeñar papel importante en la estimulación de la reparación. La composición de este tejido de reparación es diferente: la parte subcondral del defecto esta llena de tejido fibroso y cartílago hialino y la composición del tejido de reparación condral es intermedia entre la del cartílago hialino y el fibrocartílago, siendo de menor resistencia y mas vulnerable en condiciones de carga fisiológica. Las lesiones condrales puras pueden tratarse con técnicas de sustitución condral u osteocondral. Las lesiones osteocondrales requieren la colocación de hueso y cartílago. Las técnicas que penetran en el hueso subcondral se han diseñado para permitir que células de la medula ósea llenen el defecto, se forma un coagulo y estas células son capaces de formar fibrocartílago con predominio de cartílago de tipo I, que difiere del cartílago hialino (tipo II) y de inferiores propiedades mecánicas. Los defectos condrales puros pueden ser tratados también quirúrgicamente mediante técnicas de autoinjerto o aloinjerto osteocondral. Los aloinjertos de cartílago articular (fresco y fresco congelado) se han utilizado para los efectos traumáticos y patológicos desde comienzos de este siglo. Deben tenerse en cuenta para la evaluación y tratamiento de los defectos cartilaginosos varios factores que afectan la evolución de los aloinjertos y autoinjertos de cartílago: profundidad, tamaño y localización de la lesión, alineación de la extremidad, estado del cartílago meniscal y la estabilidad de los ligamentos. CARTILAGO MENISCAL El menisco es una estructura fibrocartilaginosa especializada, capaz de transmitir la carga, absorber los choques y proporcionar una estabilidad, una nutrición del cartílago articular y una propiocepción. Esta formado fundamentalmente por colágeno de tipo I, la mayor parte de estas fibras tienen una orientación circular para soportar la tensión. La matriz extracelular es una estructura bifásica formada por una fase sólida que actúa como una combinación porosa permeable reforzada con fibras, y una fase liquida, cuyo paso puede forzarse a través de la matriz sólida por un gradiente de presión hidráulica. El menisco es más elástico y menos permeable que el cartílago articular. La cara externa de cada menisco es irrigada de un plexo capilar perimeniscal procedente de las arterias geniculadas superior e inferior. Los 2/3 internos del menisco son fundamentalmente avasculares y reciben su nutrición del líquido sinovial. Pueden actuar como fuente de información propioceptiva para la coordinación muscular relativa a la extremidad. Los meniscos son estructuras dinámicas que se desplazan hacia delante con la extensión y hacia atrás con la flexión. El menisco externo es más móvil que el interno. Las formas de los meniscos mejoran la congruencia de las superficies articulares y aumentan el área de contacto articular con lo que aumentan la transmisión de las cargas a través de la articulación de la rodilla. El menisco interno proporciona también una limitación muy importante para la traslación anterior de la tibia. La perdida del menisco altera el patrón de transmisión de la carga en la rodilla y da lugar a una degeneración acelerada del cartílago articular. La extirpación de cualquier parte de tejido meniscal no debe considerarse una intervención benigna. La irrigación es importante para la cicatrización meniscal, una lesión del tercio externo da lugar a la formación de un coagulo de fibrina que actúa como andamiaje para el crecimiento de vasos sanguíneos en su interior. La lesión puede cicatrizar con tejido fibrovascular en 10 a 12 semanas. Los 2/3 internos son incapaces de cicatrizar por lo que se han planteado varios metodos como conductos de acceso vascular, injertos pediculados de sinovia, abrasión del fleco sinovial, uso de coágulos de fibrina exógenos para fomentar su cicatrización. Los métodos de sustitución meniscal que actualmente se usan son: el autoinjerto, los implantes de colágeno bovino y el aloinjerto. El material de autoinjerto utilizado ha sido la fascia lata, la almohadilla adiposa y los ligamentos que se enrollan para formar tubos y se suturan en el interior de la articulación de la rodilla. Ninguno de estos tejidos ha logrado restablecer las propiedades normales del menisco. Los aloinjertos meniscales, si tienen un tamaño correcto, continúan siendo la única técnica de que disponemos para sustituir un menisco entero. Aunque parece claro que cicatrizan hasta el tejido periférico, las muestras de biopsia han indicado la existencia de alteraciones persistentes en la composición y el contenido celulares, la arquitectura del colágeno y el contenido de proteoglicanos, lo cual plantea dudas acerca de la viabilidad a largo plazo y la predisposición a sufrir nuevas lesiones. LIGAMENTOS Están formados por tejido conjuntivo denso que une un hueso al otro. La estructura macroscópica varia según su localización (intrarticular, capsular y extraarticular) y su función. Al examen microscópico las fibras de colágeno son relativamente paralelas y están alineadas a lo largo del eje de tensión pero presentan una distribución más entrelazada de la que se observa en los tendones. Los fibroblastos que son relativamente escasos en número, se encargan de la producción y el mantenimiento de los componentes extracelulares. El ligamento cruzado anterior es más sensible al TGF-B mientras que el factor de crecimiento de origen plaquetar produce una respuesta proliferativa en el tendón rotuliano. El principal componente es el agua (60-80 %) el colágeno constituye aproximadamente 70 a 80 % del peso seco y 90% es de tipo I. La proteína elastina facilita la capacidad de alargamiento del tejido al aplicarle una carga y el restablecimiento de la longitud al retirar la carga. La tensión se define como la fuerza por unidad de superficie, y la distensión describe el cambio de longitud en relación con la longitud inicial. Cuando un ligamento se somete a una tensión se deforma de manera no lineal. Las propiedades de los lugares de inserción difieren de las de la sustancia media del ligamento y se observa una mayor distensión en estas áreas cuando se examinan bajo una tensión uniaxial. Se ha planteado que la diferencia de la tasa de lesiones del ligamento cruzado anterior con respecto a ambos sexos es debida a los receptores de estrógeno y progesterona de las células de este ligamento. Los cambios bioquímicos respecto a mayor edad incluyen una reducción del contenido de agua y colágeno, además aumenta la concentración de enlaces cruzados maduros más estables. Los fibroblastos son menos activos metabolitamente y adoptan una forma alargada. El efecto de los factores de crecimiento sobre la proliferación de los fibroblastos parece reducirse con la edad. Cuando la carga se intensifica, la masa global del ligamento aumenta y la rigidez y la carga de fallo aumentan. También hay aumento de la tensión final y la distensión de fallo. La inmovilización y la falta de uso producen efectos más notables, la carga de fallo se reduce, con la correspondiente disminución de la rigidez y el momento tensil. Con periodos mas prolongados aumenta la degradación del colágeno y se reduce su síntesis. También disminuye el agua y los proteoglicanos por lo que disminuye la masa global. La recuperación es más rápida en la sustancia que en los lugares de inserción. Después de una rotura de la sustancia del ligamento, la cicatrización se produce en 3 fases: inflamatoria, reparadora y remodelado. Una vez completa la cicatrización, las fibrillas de colágeno tienen un mayor diámetro y están mas densamente empaquetadas, con un aumento del contenido total de colágeno. La alineación del colágeno se mantiene menos organizada, persiste un aumento general del área transversal y ello contribuye a que se restablezcan las propiedades estructurales, con valores que se aproximan a los normales. Entre los factores que influyen en la cicatrización de los ligamentos se encuentran el grado de lesión, la localización del ligamento y la forma de tratamiento aplicado. El movimiento pasivo controlado da lugar a una reparación más rápida y fomenta la alineación del colágeno, la inmovilización tiene el efecto contrario. Los ligamentos intrarticulares como los cruzados, tienen una irrigación limitada y su entorno no fomenta la fase inicial de la cicatrización. La reconstrucción de ligamentos utilizando para ello un injerto que los sustituya, en especial por lo que respecta a los ligamentos cruzados, se lleva a cabo para restablecer la estabilidad articular. Las posibilidades de autoinjerto incluyen el tendón rotuliano, los tendones del semitendinoso y del gracilis, el tendón del cuadriceps, la fascia lata y la banda iliotibial. Se ha demostrado que el tendón rotuliano tiene una mayor rigidez y por tanto mayores propiedades estructurales que se ven influidas por el tamaño en comparación con los tendones poplíteos. La incorporación del injerto incluye una fase inicial de necrosis isquémica, seguida de revascularización. El remodelado y la maduración incluyen una transición de celularidad, distribución de tipos de colágeno, tamaño de fibras y alineación de estas y características bioquímicas que son mas parecidas a las del ligamento. Los datos experimentales y clínicos han indicado que los tejidos colagenosos pueden acortarse tras la aplicación de energía térmica, pero el grado de acortamiento ha sido diverso. Se ha observado histológicamente un cambio claro de la estructura de las fibras de colágeno, con una desnaturalización del tejido y un tamaño creciente del área afectada a medida que aumentara la energía utilizada. TENDONES Son tejidos fundamentalmente colagenosos, densos, que unen el músculo al hueso. Su función principal es transmitir la carga generada por el músculo al hueso. Algunos tendones están rodeados por vainas sinoviales, como ocurre en los tendones flexores de la mano, para facilitar el desplazamiento y el deslizamiento. El contenido de colágeno del peso seco es ligeramente superior al que se observa en los ligamentos y es predominantemente de tipo I en 95% y colágeno tipo III, una forma inmadura q se encuentra a menudo en tejido cicatricial, constituye el 5%. Los proteoglicanos se encuentran en una concentración muy baja, las zonas de los tendones que están sometidas a cargas de compresión son más fibrocartilaginosas y tienen un mayor contenido de glucosaminoglucanos, agrecanos y biglicanos que se aproxima al observado en el cartílago articular. La carga compresiva cíclica estimula la producción de agrecano y biglicano, intensificado además por el TGF-B. La organización y composición del tendón hacen que sea una estructura con unas características ideales para resistir fuerzas tensiles elevadas, se deforman menos que los ligamentos y son capaces de transmitir la carga del músculo al hueso. Desde un punto de vista biomecánico se ha observado un aumento de la tensión de fallo y de la rigidez durante la maduración y luego una disminución con la senescencia. Estudios experimentales sugieren que los tendones extensores tienen capacidad de respuesta a un entrenamiento, mientras que los tendones flexores actúan de manera regular en su capacidad máxima. La limitación del movimiento para proteger un tejido dañado o facilitar un proceso de reparación puede afectar a los tendones, sin la tensión como estimulo, tanto la parte media como los lugares de inserción parecen verse afectados y presentan disminución de sus propiedades biomecánicas. Una lesión puede deberse a: 1) sección transversal por el interior de la sustancia (lesión directa) se asocian a traumatismos y son mas frecuentes en los flexores de la mano 2) avulsión del tendón del hueso en el lugar de inserción (lesión indirecta) pueden producirse tras una carga tensil excesiva, como en la inserción del flexor profundo de los dedos en la base de la falange distal del dedo anular. 3) lesión en el interior de la sustancia por la acción de factores intrínsecos o extrínsecos, pueden deberse a la carga tensil repetitiva durante la vida de un individuo. La cicatrización del tendón sigue unas fases similares a las de la cicatrización de otros tejidos blandos. La respuesta inflamatoria proporciona un origen extrínseco de invasión celular para iniciar el proceso de reparación. Para lesión de los tendones avasculares en el interior de una vaina sinovial se ha propuesto un mecanismo intrínseco para la cicatrización del tendón que parece ser modulada por la tensión del movimiento pasivo. Este movimiento pasivo controlado reduce las adherencias, produce una reparación más resistente y acelera el aumento de resistencia tensil. Con la mejora de las técnicas de sutura para los tendones flexores, actualmente se puede realizar movimiento activo precoz al tiempo que evita la formación de soluciones de continuidad en la zona de reparación. Los tendones del manguito de los rotadores no tienen inserciones separadas, sino que forman una interdigitación con el tendón adyacente para dar lugar a una inserción continua en la tuberosidad mayor y menor del humero. El tercio posterior del tendón del supraspinoso es más delgado y el tercio anterior es mecánicamente más resistente que las porciones media o posterior. Se observa una mayor cantidad de glucosaminoglicanos y los proteoglicanos agrecano y biglicano se asocian a una mayor cantidad de tejido fibrocartilaginoso que se encuentra en áreas del tendón que sufren cargas compresivas. El potencial de cicatrización del tendón del manguito de los rotadores sin reparar parece ser limitado, a pesar de las pruebas de que se forma un tejido de granulación en el borde del tendón y de que se produce una respuesta vascular. MUSCULOS La unión miotendinosa es una región altamente especializada para la transmisión de la carga, con un aumento de la superficie gracias a los pliegues internos de la membrana. Cuando la fibra muscular se acorta se habla de contracción concéntrica, en una contracción excéntrica, el músculo genera una fuerza de magnitud superior a la de una contracción concéntrica y la fibra muscular se alarga. La mayor parte de los músculos del organismo tienen igual cantidad de los 2 tipos de fibras, tipo I y tipo II, las tipo I u oxidativas de contracción lenta predominan en los músculos posturales y son las más apropiadas para la resistencia mediante un metabolismo aerobio, estas fibras tienen una tensión de contracción relativamente baja. Las fibras de tipo II o de contracción rápida, se contraen de manera rápida con una tensión de contracción relativamente elevada. Las fibras de tipo IIB o fibras glucoliticas de contracción rápida son mas frecuentes en los músculos que generan una potencia de manera rápida pero tienen una mayor dependencia del metabolismo anaerobio. Las fibras tipo IIA o fibras glucoliticas oxidativas de contracción rápida, que tienen capacidad aerobia son intermedias entre las tipo I y las IIB. Con un programa de ejercicios y de carga adecuados, el músculo puede aumentar su capacidad funcional de respuesta. La flexibilidad muscular puede aumentarse con el calentamiento o la distensión de los músculos. Y a la inversa, la aplicación de frío a un grupo muscular reducirá su flexibilidad. Un entrenamiento de de tensión baja y repetición alta da lugar a mayor resistencia. El entrenamiento de tensión alta y repetición baja resalta el desarrollo de mayor fuerza y potencia muscular. Si los músculos dejan de soportar cargas ya sea por falta de uso o por inmovilización, se observa una perdida de la capacidad de resistencia y de la fuerza en los grupos musculares. A medida que el músculo se atrofia se observan cambios a nivel macro y microestructural con una disminución del tamaño y el número de fibras, así como cambios en la relación longitud tensión de las sarcomeras. Con la reanudación de la movilización, los efectos nocivos en la superficie de corte transversal del músculo y los receptores de la placa motora terminal pueden revertir, pero la densidad ósea no se restablece por completo. La lesión muscular puede deberse a una sobrecarga indirecta que supera la capacidad del músculo de responder normalmente a una lesión directa, como la contusión o la laceración. El mecanismo indirecto de lesión incluye las distensiones musculares y el dolorimiento muscular de inicio retardado. La gama de lesiones de distensión muscular puede ir desde la lesión microscópica o los desgarros parciales hasta los desgarros completos y la rotura con un defecto palpable en el músculo. Tras una lesión muscular, la cicatrización se inicia en la fase inflamatoria. El proceso de reparación incluye la proliferación de fibroblastos y la producción de colágeno que da lugar a la formación de una cicatriz, con una regeneración muscular debida a los mioblastos procedentes de células satélites. El dolorimiento muscular de inicio retardado es otra forma de lesión indirecta del músculo, este trastorno se produce como resultado de un entrenamiento o ejercicio intenso al que el músculo no esta acostumbrado. El uso de un torniquete, según estudios, no tiene efecto nocivo alguno en la recuperación funcional del músculo en un ámbito clínico. NERVIOS El cuerpo celular de la neurona da origen a un único axón, que es la extensión que transporta la señal de información en forma de un potencial graduado o de acción en el interior del sistema nervioso periférico. Un axón sensitivo transporta esta señal en forma de un impulso eléctrico que va de la periferia a su cuerpo celular situado en los ganglios de la raíz dorsal (aferente) mientras que un axón motor transporta la información del cuerpo celular situado en el asta anterior de la medula espinal (eferente) al órgano diana. La ultraestructura de un nervio periférico empieza con el axón y la vaina de mielina, que forman la fibra nerviosa, y esta envuelta por una membrana basal y una capa de tejido conjuntivo, el endoneuro. Estas fibras están agrupadas en un haz que se denomina fascículo, que esta rodeado por el perineuro. Este actúa de barrera para la difusión del liquido, un numero variable de fascículos agrupados forman el nervio periférico. Este esta envuelto por el epineuro externo. Se producen distintos tipos de patrones de lesión tras una agresión traumática sufrida por un nervio periférico. La lesión de primer grado, o neuroapraxia, comporta una perdida de la conducción a través del segmento del nervio dañado, sin degeneración walleriana ni degradación. Dado que el axón no esta interrumpido, la recuperación es completa. Una lesión de segundo grado o axonotmesis, causa daño porque el axón queda interrumpido. La neurotmesis o lesión de tercer grado es más grave ya que el nervio esta interrumpido, sufren daño las estructuras situadas por dentro del perineuro, las fibras nerviosas del fascículo. En una lesión de cuarto grado se pierde la estructura interfascicular, pero el epineuro externo se mantiene inalterado. Las probabilidades de regeneración efectiva son mínimas y generalmente esta indicado tratamiento quirúrgico. La lesión mas grave es la de quinto grado, el nervio esta completamente interrumpido y es probable que se forme una cicatriz en los extremos seccionados. Tras la reparación de un nervio se produce una regeneración a una velocidad media de 1 mm/día en el ser humano. Existen varios factores que aplicados de manera local o sistémica fomentan la regeneración: hormonas, proteínas, IGF, el factor de crecimiento fibroblastico acido, campos eléctricos de corriente continua, oxigeno hiperbarico. La reparación del nervio periférico se utiliza para restablecer la continuidad del nervio. La reparación primaria es preferible a las técnicas alternativas de injerto nervioso. De los dos tipos de reparación nerviosa, la reparación con sutura fascicular tiene, teóricamente una probabilidad de restablecer correctamente la función nerviosa superior a la sutura epineural. En las lesiones nerviosas en que existe un espacio de separación y que no son reparables o que tendrían una tensión excesiva si se reparan, se plantea la posibilidad de realizar un injerto nervioso. El tratamiento estándar es el injerto autógeno. Los orígenes mas habituales son el nervio safeno interno o los nervios cutáneos interno o externo del antebrazo.