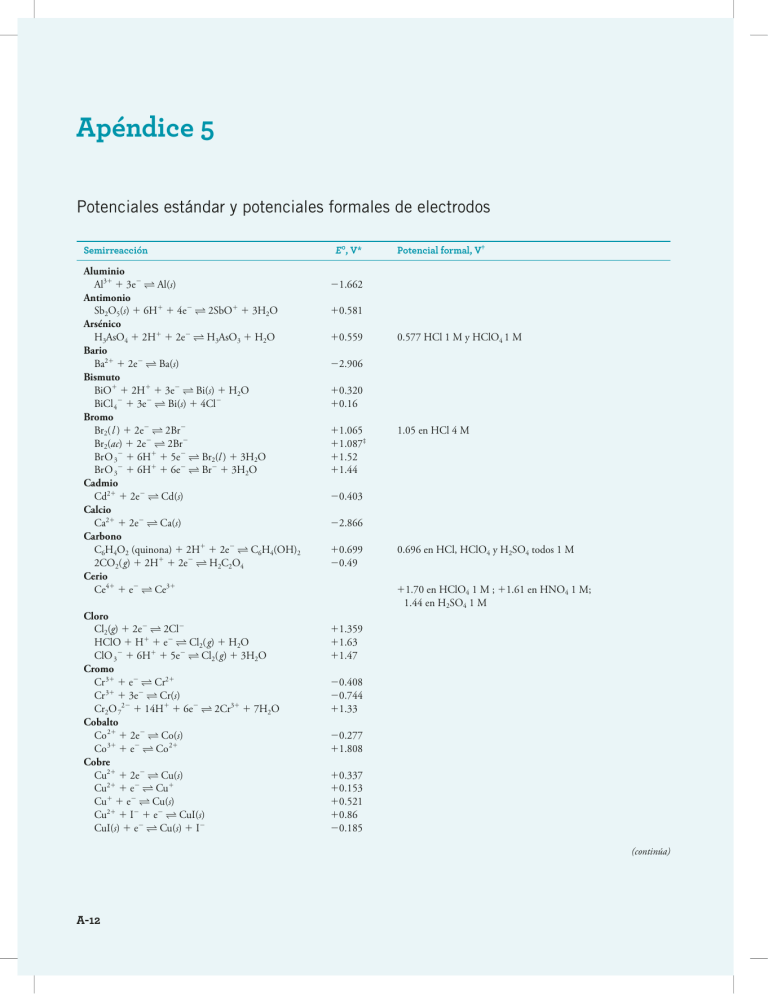
Apéndice 5 Potenciales estándar y potenciales formales de electrodos Semirreacción Aluminio Al31 1 3e2 Al(s) Antimonio Sb2O5(s) 1 6H1 1 4e2 2SbO1 1 3H2O Arsénico H3AsO4 1 2H1 1 2e2 H3AsO3 1 H2O Bario Ba21 1 2e2 Ba(s) Bismuto BiO1 1 2H1 1 3e2 Bi(s) 1 H2O BiCl 42 1 3e2 Bi(s) 1 4Cl2 Bromo Br2( l ) 1 2e2 2Br2 Br2(ac) 1 2e2 2Br2 BrO 32 1 6H1 1 5e2 Br2(l ) 1 3H2O BrO 32 1 6H1 1 6e2 Br2 1 3H2O Cadmio Cd21 1 2e2 Cd(s) Calcio Ca21 1 2e2 Ca(s) Carbono C6H4O2 (quinona) 1 2H1 1 2e2 C6H4(OH)2 2CO2( g) 1 2H1 1 2e2 H2C2O4 Cerio Ce41 1 e2 Ce31 Cloro Cl2(g) 1 2e2 2Cl2 HClO 1 H1 1 e2 Cl2( g) 1 H2O ClO 32 1 6H1 1 5e2 Cl2( g) 1 3H2O Cromo Cr 31 1 e2 Cr21 Cr 31 1 3e2 Cr(s) Cr2O 722 1 14H1 1 6e2 2Cr31 1 7H2O Cobalto Co 21 1 2e2 Co(s) Co 31 1 e2 Co 21 Cobre Cu21 1 2e2 Cu(s) Cu21 1 e2 Cu1 Cu1 1 e2 Cu(s) Cu21 1 I2 1 e2 CuI(s) CuI(s) 1 e2 Cu(s) 1 I2 E 0, V* Potencial formal, V† 21.662 10.581 10.559 0.577 HCl 1 M y HClO4 1 M 22.906 10.320 10.16 11.065 11.087‡ 11.52 11.44 1.05 en HCl 4 M 20.403 22.866 10.699 20.49 0.696 en HCl, HClO4 y H2SO4 todos 1 M 11.70 en HClO4 1 M ; 11.61 en HNO4 1 M; 1.44 en H2SO4 1 M 11.359 11.63 11.47 20.408 20.744 11.33 20.277 11.808 10.337 10.153 10.521 10.86 20.185 (continúa) A-12 Potenciales estándar y potenciales formales de electrodosA-13 Semirreacción Flúor F2(g) 1 2H1 1 2e2 2HF(ac) Hidrógeno 2H1 1 2e2 H2 (g) Yodo I2(s) 1 2e2 2I2 I2(ac) 1 2e2 2I2 I 32 1 2e2 3I2 ICl 22 1 e2 I2(s) 1 2Cl2 IO 32 1 6H1 1 5e2 I2(s) 1 3H2O IO 32 1 6H1 1 5e2 I2(ac) 1 3H2O IO 32 1 2Cl2 1 6H1 1 4e2 ICl 22 1 3H2O H5IO 6 1 H1 1 2e2 IO 32 1 3H2O Hierro Fe21 1 2e2 Fe(s) Fe31 1 e2 Fe21 Fe(CN) 632 1 e2 Fe(CN) 642 Plomo Pb 21 1 2e2 Ps(s) PbO 2(s)1 4H1 1 2e2 Pb 21 1 2H2O PbSO4 (s)1 2e2 Pb(s) 1 SO 422 Litio Li1 1 e2 Li(s) Magnesio Mg21 1 2e2 Mg(s) Manganeso Mn21 1 2e2 Mn(s) Mn31 1 e2 Mn21 MnO 2 (s) 1 4H1 1 2e2 Mn21 1 2H2O MnO 42 1 8H1 1 5e2 Mn21 1 4H2O MnO 42 1 4H1 1 3e2 MnO2(s) 1 2H2O MnO 42 1 e2 MnO422 Mercurio Hg 221 1 2e2 2Hg(l ) 2Hg 21 1 2e2 Hg 221 Hg 21 1 2e2 Hg(l ) Hg 2Cl2(s)1 2e2 2Hg(l ) 1 2Cl2 Hg 2SO4(s)1 2e2 2Hg(l ) 1 SO 422 Níquel Ni21 1 2e2 Ni(s) Nitrógeno N2( g ) 1 5H1 1 4e2 N2H 51 HNO2 1 H1 1 e2 NO(g) 1 H2O NO 32 1 3H1 1 2e2 HNO2 1 H2O Oxígeno H2O2 1 2H1 1 2e2 2H2O HO 22 1 H2O 1 2e2 3OH2 O2(g) 1 4H1 1 4e2 2H2O O2(g) 1 2H1 1 2e2 H2O2 O3(g) 1 2H1 1 2e2 O2( g ) 1 H2 O Paladio Pd 21 1 2e2 Pd(s) E 0, V* Potencial formal, V† 13.06 0.000 20.005 en HClO4, HCl 1 M 10.5355 10.615‡ 10.536 11.056 11.196 11.178‡ 11.24 11.601 20.440 10.771 10.36 20.126 11.455 20.350 0.700 en HCl 1 M; 0.732 en HCO4 1 M; 0.68 en H2SO4 1 M 0.71 en HCl 1 M; 0.72 en HCO4, H2SO4 1 M 20.14 en HClO4 1 M; 20.29 en H2SO4 1 M. 23.045 22.363 21.180 1.51 en H2SO4 7.5 M 11.23 11.51 11.695 10.564 10.788 10.920 10.854 10.268 10.615 0.274 en HCl 1 M; 0.776 en HClO4 1 M; 0.674 en H2SO4 1 M 0.907 en HClO4 1 M 0.244 en KCl saturado; 0.282 en KCl 1 M; 0.334 en KCl 0.1 M 20.250 20.23 11.00 10.94 0.92 en HNO3 1 M 11.776 10.88 11.229 10.682 12.07 10.987 (continúa) A-14APÉNDICE 5 Potenciales estándar y potenciales formales de electrodos Semirreacción Platino PtCl 422 1 2e2 Pt(s) 1 4Cl2 PtCl 622 1 2e2 PtCl 422 1 2Cl2 Potasio K1 1 e2 K(s) Selenio H2SeO3 1 4H1 1 4e2 Se(s) 1 3H2O SeO 422 1 4H1 1 2e2 H2SeO3 1 H2O Plata Ag1 1 e2 Ag(s) AgBr(s) 1 e2 Ag(s) 1 Br2 AgCl(s) 1 e2 Ag(s) 1 Cl2 Ag(CN) 22 1 e2 Ag(s) 1 2CN2 Ag2CrO4(s) 1 2e2 2Ag(s) 1 CrO 422 AgI(s) 1 e2 Ag(s) 1 I2 Ag(S2O3) 232 1 e2 Ag(s) 1 2S2O 322 Sodio Na1 1 e2 Na(s) Azufre S(s) 1 2H1 1 2e2 H2S(g) H2SO3 1 4H1 1 4e2 S(s) 1 3H2O SO 422 1 4H1 1 2e2 H2SO3 1 H2O S4O 622 1 2e2 2S2O 322 S2O 822 1 2e2 2SO 422 Talio Tl1 1 e2 Tl(s) Tl31 1 2e2 Tl1 Estaño Sn 21 1 2e2 Sn(s) Sn 41 1 2e2 Sn21 Titanio Ti31 1 e2 Ti21 TiO 21 1 2H1 1 e2 Ti31 1 H2O Uranio UO 221 1 4H1 1 2e2 U 41 1 2H2O Vanadio V31 1 e2 V21 VO21 1 2H1 1 e2 V31 1 H2O V(OH) 41 1 2H1 1 e2 VO 21 1 3H2O Zinc Zn21 1 2e2 Zn(s) E 0, V* Potencial formal, V† 10.755 10.68 22.925 10.740 11.15 10.799 10.073 10.222 20.31 10.446 20.151 10.017 0.228 en HCl 1 M; 0.792 en HClO4 1 M; 0.77 en H2SO4 1 M 0.228 en KCl 1 M 22.714 10.141 10.450 10.172 10.08 12.01 20.336 11.25 20.551 en HCl 1 M; 20.33 en HClO4 1 M, H2SO4 1 M 0.77 en HCl 1 M 20.136 10.154 20.16 en HClO4 1 M 0.14 en HCl 1 M 20.369 10.099 0.04 en H2SO4 1 M 10.334 20.255 10.337 11.00 1.02 en HCl, HClO4 1 M 20.763 *G. Milazzo, S. Caroli y V. K. Sharma, Tables of Standard Electrode Potentials, Londres: Wiley, 1978. E. H. Swift y E. A. Butler, Quantitative Measurements and Chemical Equilibria, Nueva York: Freeman, 1972. Estos potenciales son hipotéticos debido a que corresponden a disoluciones de Br2 y I2 0.100 M. Las solubilidades de estos dos compuestos a 25 oC son de 0.18 M y 0.0020 M, respectivamente. En disoluciones saturadas que contienen un exceso de Br2(l) o I2(s), se deben utilizar los potenciales estándar para la semirreacción Br2(l) 1 2e- 2Br2 o I2(s) 1 2e2 2I2. En contraste, a concentraciones de Br2 y I2 menores a la saturación, estos potenciales de electrodos hipotéticos deben ser utilizados.