Reacciones con enolatos
Anuncio
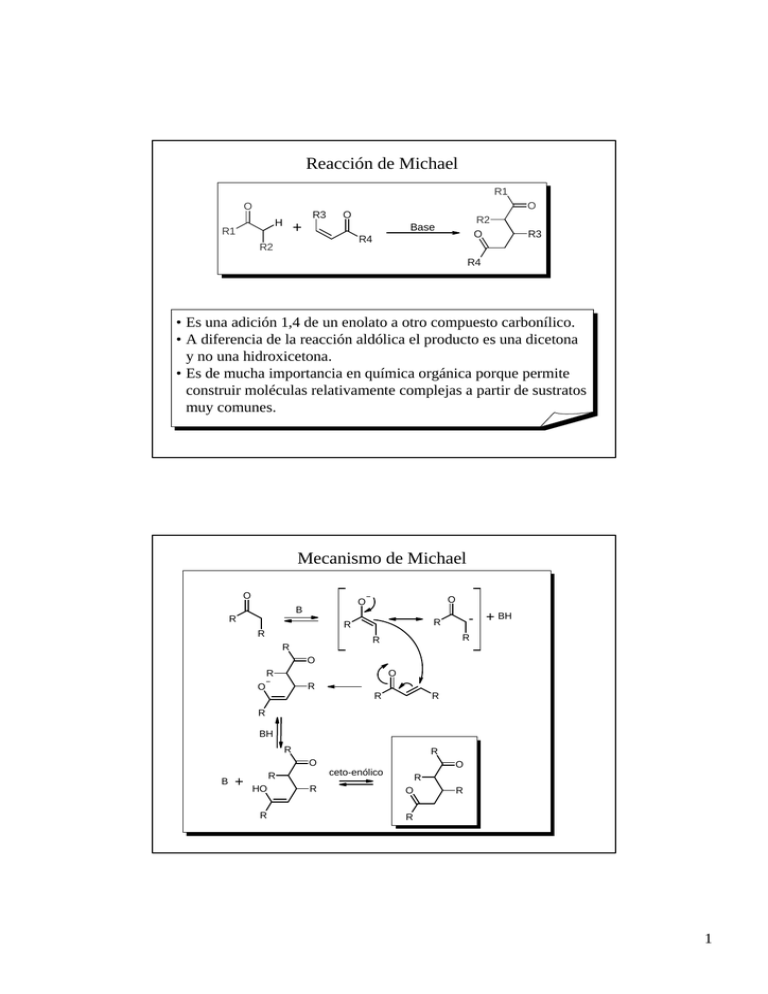
Reacción de Michael R1 O R3 H R1 O O + R2 O Base R4 R2 R3 R4 • Es una adición 1,4 de un enolato a otro compuesto carbonílico. • A diferencia de la reacción aldólica el producto es una dicetona y no una hidroxicetona. • Es de mucha importancia en química orgánica porque permite construir moléculas relativamente complejas a partir de sustratos muy comunes. Mecanismo de Michael O O O B R R R R - + BH R R R O O R R O R R R BH R R O B + HO R O ceto-enólico R R R O R R 1 O O + Ejemplos de la Reacción de Michael Base H O O O + Base + Base O O O O O + Base O Base O O O + O Base H Anelación de Robinson H + O Base O O • Consiste en una reacción de Michael seguida de una condensación aldólica intramolecular. • Cualquier cetona cíclica funciona en la reacción pero ciclohexanona es la mas común. Metil vinil cetona es el aceptor de Michael mas utilizado • Es uno de los mejores métodos para construir ciclos fusionados de 6 miembros. 2 Mecanismo de Robinson O O B O - + BH H H - O O O O O abi O O O O Continúa Mecanismo de Robinson (cont.) BH - O O H O O O O BH HO O + B + O 3 O O + O O + O Ejemplos de la Reacción de Robinson Base Base O O + Base O + Base O O + Ph Base O Ph Condensación de Claisen O O H O R1 R2 + O Base O R1 R2 O + O R1 R2 R1 OH R2 • En esta reacción el enolato derivado de un éster ataca al grupo carboxílico de otra molécula de éster para formar un cetoester. • Se la puede considerar como análoga a la condensación aldólica de aldehídos y cetonas. • Si los ésteres que intervienen son distintos se habla de Condensación de Claisen cruzada. • La variante intramolecular se denomina Condensación de Dieckmann. 4 Mecanismo de la Condensación de Claisen O H O R1 R2 R1 + R2 R2 R1 O O O O R1 R2 + BH - O O R1 O R1 O O B R1 R2 R2 R1 R2 O O O R2 O O BH R1 OH + B Ejemplos de Condensación de Claisen O - MeO , MeOH O O O - EtO , EtOH O O O O 1. Base + O 2. O O B (C13H18O3) ? O C (C11H14O3) O 1. Base, ∆ O 2. proponga la base mas adecuada O A (C9H14O3) 5 Reacción de Knoevenagel O R1 O O R1 R2 H + H O O R2 O R3 + Base O R3 O R1 H2O O R1 • Es una condensación entre un diéster y un compuesto carbonílico. • En esta reacción nunca se aísla el producto de adición. • Es un buen método para la síntesis de diésteres α,β-insaturados. • Los productos son buenos intermediarios de síntesis ya que son susceptibles de diversas reacciones posteriores: ataque 1,4; ozonólisis, hidrogenación, etc. • Reacciones análogas se observan entre compuestos carbonílicos Mecanismo de la Reacción de Knoevenagel O R1 O R1 O R1 O O H O O O - B H O + BH O O R1 O R1 O R1 HO O B O R1 O + H O R1 R2 R3 O BH O R1 O R1 O O R2 R3 O R2 O R3 O R1 O R1 O R1 O R2 O R3 + HO + BH H2O + B O R1 6 Ejemplos de la Reacción de Knoevenagel O O O + NaH ∆ C (C11H14O2) A (C10H16O2) O - 1. MeO , MeOH, 60 ºC O O 2. O H2, Pd/C O Ph O A (C14H16O4) - 1. MeO , MeOH, 60 ºC O O + O 2. O O EtO-, EtOH H O B (C8H12O3) A (C8H12O3) H O B (C14H18O4) 1. OH 2. H+, ∆ ∆ A (C9H12O3) Reacción de Mannich H O O + NH3 + H H R1 R2 H H2N H H O R1 R2 Base de Mannich - NH3 R1 O R2 • Es una reacción entre 3 compuestos: una cetona, amoníaco (también puede ser una amina) y formaldehído (también se da con otros aldehídos y cetonas reactivas). • El producto final puede ser la base de Mannich, la cetona α,βinsaturada u otros compuestos relacionados. • Comienza por la reacción entre el aldehído y la amina para dar un sal de iminio. A veces esa sal se prepara en una reacción previa. En ese caso se trata de un reactivo especifico llamado Sal de Eschenmoser. 7 Mecanismo de la Reacción de Mannich + O H O NH3 + NH3 H H H + NH3 NH3 + O R2 ∆ H H2N R1 + NH4 R2 R1 R2 R1 H + H + R1 O NH2 H O - R2 R1 NH2 H O H + HO NH2 O R2 Base de Mannich Ejemplos de la Reacción de Mannich O 1. LDA NH3 , CH2O ∆ A 2. [Me2N=CH2]+I- B (C7H10O) PhMgBr C (C13H16O) ∆ D O + + A NH2 Cl O + + A NH2 Cl O O + H N + N N proponga un mecanismo razonable O O + H H + NH2 KCN pH 4 - 5 CN 8



