∫ ∫ ∫ ∫ ∫ + ∫
Anuncio

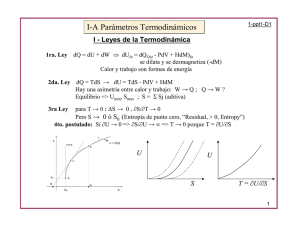
UNAM. Facultad de Química Termodinámica Teoría (1212) Primera Ley de la Termodinámica. Calor de combustión a volumen constante Universo: sistema y sus alrededores Ecuación energética: www.nist.gov U Q W ¿Qué es la energía interna? La energía que tiene el sistema, involucrando a los átomos que lo componen y sus constituyentes (electrones, protones, neutrones), así como sus comportamientos (vibración, rotación, translación, etc.) de forma individual o como parte de agregados químicos (retículas, moléculas, etc.) U Q W ; variación de U dU Q W ; diferencial exacta = diferencial inexacta + diferencial inexacta i) Proceso a V = cte; W = -PopdV; dV= 0; W = 0 dU = QV U2 integrando: 2 dU QV U1 1 QV U ii) Proceso a P = cte dU Q W W =- PopdV; W = - PdV dU = QP V2 Qp U 2 U1 P dV Pop Pgas P V1 Qp U 2 U1 P(V2 V1 ) ; P = P1 = P2 Qp U 2 U1 PV 2 2 PV 1 1 – PdV Qp (U 2 PV 2 2 ) (U1 PV 1 1) QP = dU + PdV; integrando 2 Q P 1 U2 V2 U1 V1 Definimos entalpía: dU PdV H U PV para un estado definido: Qp H 2 H1 Editado por RMAER <ricjustosierra@yahoo.com> Qp H